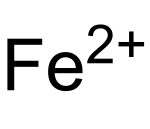A | B | C | D | E | F | G | H | CH | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | X | Y | Z | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9
Fentonovo činidlo je roztok peroxidu vodíka (H2O2) a železnatých iónov[1] (typicky v podobe síranu železnatého, FeSO4) ako katalyzátora, ktoré sa používa na oxidáciu kontaminantov alebo odpadových vôd v rámci oxidačných procesov. Fentonovo činidlo možno použiť na rozklad organických zlúčenín, napríklad trichlóretylénu (TCE) či tetrachlóretylénu (perchloroetylénu, PCE). Toto činidlo vyvinul Henry John Horstman Fenton ako analytické činidlo v roku 1894.[2][3][4]
Podľa niektorých definícií môže Fentonovo činidlo obsahovať iné kovové katalyzátory, typicky však ide o železo.[1][5] Medzi ďalšie kovy, ktoré katalyzujú podobné reakcie, patria kobalt a meď.[6]
Reakcie
Peroxid vodíka oxiduje železnaté katióny na železité katióny, čím vzniká hydroxylový radikál a hydroxidový ión. Železitý katión sa potom redukuje naspäť na železnatý katión v reakcii s ďalšou molekulou peroxidu vodíka, čím vzniká hydroperoxylový radikál a protón. Výsledkom týchto reakcií je teda disproporcionácia peroxidu vodíka, ktorou vznikajú dve reaktívne formy kyslíka a ako vedľajší produkt vzniká voda (H+ + OH-).[5][6][7]
- Fe2+ + H2O2 → Fe3+ + HO• + OH−
- Fe3+ + H2O2 → Fe2+ + HOO• + H+
- 2 H2O2 → HO• + HOO• + H2O
Tieto reakcie sa často označujú ako Fentonova reakcia. Okrem týchto reakcií prebiehajú i ďalšie.[6]
Voľné radikály, ktoré vznikajú v týchto procesoch, sa účastnia sekundárnych reakcií. Hydroxylový radikál je napríklad silný neselektívny oxidant.[8] Oxidácia organických zlúčenín pomocou Fentonovho činidla je rýchla a exotermická a vedie k oxidácii kontaminantov, čím vzniká hlavne oxid uhličitý a voda.
Prvá reakcia (vznik hydroxylového radikálu) bola opísaná Haberom a Weissom v 30. rokoch 20. storočia a označuje sa i ako Haberova–Weissova reakcia.[9]
Ako katalyzátor sa typicky používa síran železnatý. Presný mechanizmus tohto redoxného cyklu nie je známy a boli navrhnuté i mechanizmy oxidácie organických zlúčenín, ktore prebiehajú cez iné látky než HO•.[chýba zdroj
Elektrochémia
V elektro-Fentonových procesoch vzniká peroxid vodíka in situ vďaka elektrochemickej readukcii kyslíku.[10]
Efekt pH na tvorbu rôznych radikálov
pH ovplyvňuje rýchlosť reakcie z niekoľkých dôvodov. Pri nízkom pH dochádza k tvorbe komplexov Fe2+, čo znamená nižšiu dostupnosť týchto katiónov na tvorbu reaktívnych foriem kyslíka (hlavne •OH).[11] Pri nižšom pH takisto dochádza k reakcii •OH s nadbytkom H+,[12] čo spomaľuje rýchlosť reakcie. Naproti tomu pri vysokom pH sa reakcia spomaľuje kvôli zrážaniu Fe(OH)3, čím sa znižuje koncentrácia Fe3+ v roztoku.[13] Rozpustnosť zlúčenín železa je priamo daná pH roztoku. Katión Fe3+ je asi 100× menej rozpustný než katión Fe2+ v bežnej vode pri neutrálnom pH, takže koncentrácia železitých katiónov je limitujúcim faktorom rýchlosti reakcie. Pri vysokom pH je takisto ovplyvnená stabilita H2O2, čo vedie k jeho samovoľnému rozkladu.[14] Vyššie pH takisto znižuje redoxný potenciál •OH, čím sa znižuje jeho účinnosť.[15] pH teda hrá významnú úlohu pri tvorbe voľných radikálov a tým ovplyvňuje rýchlosť reakcie. Prebiehajúce výskumy sa teda snažia optimalizovať pH a iné parametre na ovplyvnenie rýchlosti prebiehajúcich reakcií.[16]
Pôsobenie pH na rýchlosť reakcie Nízke pH Tvorba komplexu 2+, čím sa znižuje koncentrácia Fe2+ Nadbytok H+ vychytáva vznikajúci •OH High pH Nižší redoxný potenciál •OH Samovoľný rozklad H2O2 kvôli nižšej stabilite pri vysokom pH Zrážanie Fe(OH)3 z roztoku
Biologický význam
Fentonova reakcia má význam v biológii, pretože vedie k tvorbe voľných radikálov pomocou chemických látok, ktoré sú bežne prítomné in vivo v bunkách.[17] Ióny prechodných kovov, napríklad železa a medi, môžu darovať alebo prijať voľné elektróny v intracelulárnych reakciách a tým prispieť k tvorbe či prípadne vychytávaniu voľných radikálov. Superoxidové ióny a prechodné kovy pôsobia synergicky a spôsobujú tvorbu voľných radikálov.[18] Kvôli tomu, aj keď klinický význam nie je stále presne známy, je to jeden z dôvodov, prečo sa pacientom s infekciami neodporúča brať doplnky stravy so železom. Medzi ďalšie dôvody patria infekcie sprostredkované železom.[19]
Železo sa v tele často vyskytuje vo viazanej podobe, napríklad v podobe hemu alebo iných proteínov, napríklad feritínu.[20] Feritín viaže nereaktívne Fe3+ a tak pomáha predchádzať poškodeniu buniek Fentonovou reakciou.[21]
Použitie
Fentonovo činidlo sa používa na čistenie odpadových vôd.[22]
Fentonovo činidlo možno použiť v rôznych chemických procesoch, ktoré vyžadujú hydroxylový ión alebo oxidujú niektoré zlúčeniny.[23]
Fentonovo činidlo sa používa v organickej syntéze na hydroxyláciu arénov pomocou radikálovej substitúcie, napríklad pri premene benzénu na fenol:
- C6H6 + FeSO4 + H2O2 → C6H5OH
Príkladom hydroxylácie je i oxidácia kyseliny barbiturovej na aloxán.[24] Ďalším použitím sú coupling reakcie alkánov. Príkladom je dimerizácia terc-butanolu pomocou Fentonovho činidla a kyseliny sírovej, čím vzniká 2,5-dimetyl-2,5-hexándiol.[25]
Fentonovo činidlo sa bežne používa i v environmentálnych vedách na čistenie vody a remediáciu pôdy. Mnohé nebezpečné odpadné vody sa podarilo účinne očistiť pomocou Fentonovho činidla.[13]
Referencie
- ↑ a b Atlas sanačných metód - Informačný systém environmentálnych záťaží . envirozataze.enviroportal.sk, . Dostupné online.
- ↑ The centennial of the Fenton reaction. Free Radical Biology and Medicine, 1 December 1993, s. 645–651. DOI: 10.1016/0891-5849(93)90168-t. PMID 8138191.
- ↑ FENTON, H. J. H.. Oxidation of tartaric acid in presence of iron. Journal of the Chemical Society, Transactions, 1894, s. 899–911. Dostupné online. DOI: 10.1039/ct8946500899.
- ↑ Superoxide ion: Generation and chemical implications. Chemical Reviews, 2016, s. 3029–3085. DOI: 10.1021/acs.chemrev.5b00407. PMID 26875845.
- ↑ a b Fenton's reaction . www.lenntech.com, . Dostupné online.
- ↑ a b c AMETA, Rakshit; K. CHOHADIA, Anil; JAIN, Abhilasha. Chapter 3 - Fenton and Photo-Fenton Processes. : Academic Press, 2018-01-01. DOI: 10.1016/B978-0-12-810499-6.00003-6. Dostupné online. ISBN 978-0-12-810499-6. DOI:10.1016/b978-0-12-810499-6.00003-6 S. 49–87. (po anglicky)
- ↑ VASQUEZ-MEDRANO, Ruben; PRATO-GARCIA, Dorian; VEDRENNE, Michel. Chapter 4 - Ferrioxalate-Mediated Processes. : Academic Press, 2018-01-01. DOI: 10.1016/B978-0-12-810499-6.00004-8. Dostupné online. ISBN 978-0-12-810499-6. DOI:10.1016/b978-0-12-810499-6.00004-8 S. 89–113. (po anglicky)
- ↑ CAI, Q.Q.; JOTHINATHAN, L.; DENG, S.H.. Advanced Oxidation Processes for Effluent Treatment Plants. : , 2021. ISBN 978-0-12-821011-6. DOI:10.1016/b978-0-12-821011-6.00011-6 Fenton- and ozone-based AOP processes for industrial effluent treatment, s. 199–254.
- ↑ Über die katalyse des hydroperoxydes. Naturwissenschaften, 1932, s. 948–950. DOI: 10.1007/BF01504715.
- ↑ Mineralization of aromatics in water by sunlight-assisted electro-Fenton technology in a pilot reactor. Environmental Science and Technology, January 2005, s. 1843–1847. Dostupné online. DOI: 10.1021/es0498787. PMID 15819245.
- ↑ Degradation of melatonin by UV, UV/H2O2, Fe2+/H2O2 and UV/Fe2+/H2O2 processes. Separation and Purification Technology, 5 August 2009, s. 261–266. DOI: 10.1016/j.seppur.2009.05.013.
- ↑ 2,4-Dichlorophenol Oxidation Kinetics by Fenton's Reagent. Environmental Technology, 1 December 1996, s. 1371–1378. DOI: 10.1080/09593330.1996.9618465.
- ↑ a b Fluidized-bed Fenton technologies for recalcitrant industrial wastewater treatment–Recent advances, challenges and perspective. Water Research, 15 February 2021, s. 116692. DOI: 10.1016/j.watres.2020.116692. PMID 33279748.
- ↑ A Comparative study on oxidation of disperse dyes by electrochemical process, ozone, hypochlorite and fenton reagent. Water Research, 1 June 2001, s. 2129–2136. DOI: 10.1016/s0043-1354(00)00487-5. PMID 11358291.
- ↑ Heterogeneous fenton and photo-fenton oxidation for paracetamol removal using iron containing ZSM-5 zeolite as catalyst. AIChE Journal, 2017, s. 669–679. Dostupné online. DOI: 10.1002/aic.15369.
- ↑ Application of a Multiobjective Artificial Neural Network (ANN) in Industrial Reverse Osmosis Concentrate Treatment with a Fluidized Bed Fenton Process: Performance Prediction and Process Optimization. ACS ES&T Water, 9 April 2021, s. 847–858. DOI: 10.1021/acsestwater.0c00192.
- ↑ Cryptosporidium-contaminated water disinfection by a novel Fenton process. Free Radical Biology and Medicine, 2017, s. 158–167. DOI: 10.1016/j.freeradbiomed.2017.02.030. PMID 28212822.
- ↑ Robbins; Cotran. Pathologic basis of disease. 7th. vyd. : Elsevier, 2008. ISBN 978-0-8089-2302-2. S. 16.
- ↑ Iron supplementation in the intensive care unit: when, how much, and by what route?. Critical Care, 14 June 2004, s. S37-41. DOI: 10.1186/cc2825. PMID 15196322.
- ↑ EMS, Thomas; ST LUCIA, Kayla; HUECKER, Martin R.. Biochemistry, Iron Absorption. Treasure Island (FL) : StatPearls Publishing, 2022. PMID: 28846259. Dostupné online.
- ↑ MACKENZIE, Elizabeth L.; IWASAKI, Kenta; TSUJI, Yoshiaki. Intracellular Iron Transport and Storage: From Molecular Mechanisms to Health Implications. Antioxidants & Redox Signaling, 2008-06, roč. 10, čís. 6, s. 997–1030. Dostupné online . ISSN 1523-0864. DOI: 10.1089/ars.2007.1893. (po anglicky)
- ↑ CHEN, Yan-Jhang; FAN, Tang-Yu; WANG, Li-Pang. Application of Fenton Method for the Removal of Organic Matter in Sewage Sludge at Room Temperature. Sustainability, 2020-02-18, s. 1518. Dostupné online. ISSN 2071-1050. DOI: 10.3390/su12041518.
- ↑ Fenton’s Reaction - Reaction Details, Reagent, Applications, FAQs . . Dostupné online. (po anglicky)
- ↑ Transformation of barbituric acid into alloxan by hydroxyl radicals: interaction with melatonin and with other hydroxyl radical scavengers. Journal of Pineal Research, November 2002, s. 239–247. DOI: 10.1034/j.1600-079X.2002.02936.x. PMID 12390507.
- ↑ α,α,α',α'-TETRAMETHYLTETRAMETHYLENE GLYCOL . www.orgsyn.org, . Dostupné online. (po anglicky)
Literatúra
- The Fenton reagents. Free Radical Biology and Medicine, 1993, s. 435–445. DOI: 10.1016/0891-5849(93)90043-T. PMID 8225025.
- BARBUSIŃSKI, K.. Fenton Reaction – Controversy concerning the chemistry. Ecological Chemistry and Engineering, 2009, s. 347–358. Dostupné online.
Zdroj
Tento článok je čiastočný alebo úplný preklad článku Fenton's reagent na anglickej Wikipédii.
Text je dostupný za podmienok Creative Commons Attribution/Share-Alike License 3.0 Unported; prípadne za ďalších podmienok. Podrobnejšie informácie nájdete na stránke Podmienky použitia.
Antropológia
Aplikované vedy
Bibliometria
Dejiny vedy
Encyklopédie
Filozofia vedy
Forenzné vedy
Humanitné vedy
Knižničná veda
Kryogenika
Kryptológia
Kulturológia
Literárna veda
Medzidisciplinárne oblasti
Metódy kvantitatívnej analýzy
Metavedy
Metodika
Text je dostupný za podmienok Creative
Commons Attribution/Share-Alike License 3.0 Unported; prípadne za ďalších
podmienok.
Podrobnejšie informácie nájdete na stránke Podmienky
použitia.
www.astronomia.sk | www.biologia.sk | www.botanika.sk | www.dejiny.sk | www.economy.sk | www.elektrotechnika.sk | www.estetika.sk | www.farmakologia.sk | www.filozofia.sk | Fyzika | www.futurologia.sk | www.genetika.sk | www.chemia.sk | www.lingvistika.sk | www.politologia.sk | www.psychologia.sk | www.sexuologia.sk | www.sociologia.sk | www.veda.sk I www.zoologia.sk