A | B | C | D | E | F | G | H | CH | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | X | Y | Z | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9
| Tomuto článku alebo sekcii chýbajú odkazy na spoľahlivé zdroje, môže preto obsahovať informácie, ktoré je potrebné ešte overiť. Pomôžte Wikipédii a doplňte do článku citácie, odkazy na spoľahlivé zdroje. |
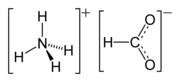
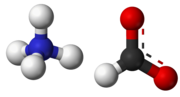
| Mravčan amónny | |||||||||||||||||||||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||||||||||||||||||||
| Sumárny vzorec | NH4HCO2 | ||||||||||||||||||||||||||||||||
| Vzhľad | Biely hygroskopický prášok | ||||||||||||||||||||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||||||||||||||||||||
| Molekulová hmotnosť | 63,1 u | ||||||||||||||||||||||||||||||||
| Molárna hmotnosť | 63,0559 g/mol | ||||||||||||||||||||||||||||||||
| Teplota topenia | 116 °C | ||||||||||||||||||||||||||||||||
| Teplota rozkladu | 180 °C | ||||||||||||||||||||||||||||||||
| Hustota | 1.280 g/cm³ | ||||||||||||||||||||||||||||||||
| Rozpustnosť | vo vode: 102 g/100 ml (0 °C) 143 g/100 ml (20 °C) 531 g/100 ml (80 °C) v polárnych rozpúšťadlách: kvapalný amoniak alkohol dietyléter | ||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| Ďalšie informácie | |||||||||||||||||||||||||||||||||
| Číslo CAS | 540-69-2 | ||||||||||||||||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||||||||||||||||||||
Mravčan amónny (NH4HCO2) je amónna soľ kyseliny mravčej. Je to bezfarebná, hygroskopická, kryštalická pevná látka.
Použitie
Čistý mravčan amónny sa rozkladá na formamid a vodu. Kyselinu mravčiu je možno získať reakciou mravčanu amónneho so zriedenou kyselinou a pretože mravčan amónny sa tiež vyrába z kyseliny mravčej, môže slúžiť ako spôsob uloženia kyseliny mravčej.
V prítomnosti paládia sa mravčan amónny rozkladá na vodík, oxid uhličitý a na amoniak. Vodík adsorbuje na povrch kovového paládia, kde môže reagovať s rôznymi funkčnými skupinami. Napríklad alkény môžu byť adované na alkány, alebo formaldehyd na metanol. Aktivované jednoduché väzby na heteroatómy a tiež môžu byť nahradené atómami vodíka (hydrogenácia).
Mravčan amónny môže byť použitý v Leuckartovej reakcii. Môže sa tiež použiť ako vyrovnávacia pamäť v kvapalinovej chromatografii (HP-LC), a je vhodný pre použitie v hmotnostnej spektrometrii s kvapalinovou chromatografiou ( LC/MS). Hodnoty kyslej disociačnej konštanty kyseliny mravčej a amónneho iónu sú 3,8 a 9,2.
Reakcia
Pri zahriatí mravčanu amónneho sa odstraňuje voda, tvorí sa formamid. Pri ďalšom zahrievaní sa tvorí amoniak a voda.
Zdroj
Tento článok je čiastočný alebo úplný preklad článku Ammonium formate na anglickej Wikipédii.
Text je dostupný za podmienok Creative Commons Attribution/Share-Alike License 3.0 Unported; prípadne za ďalších podmienok. Podrobnejšie informácie nájdete na stránke Podmienky použitia.
Antropológia
Aplikované vedy
Bibliometria
Dejiny vedy
Encyklopédie
Filozofia vedy
Forenzné vedy
Humanitné vedy
Knižničná veda
Kryogenika
Kryptológia
Kulturológia
Literárna veda
Medzidisciplinárne oblasti
Metódy kvantitatívnej analýzy
Metavedy
Metodika
Text je dostupný za podmienok Creative
Commons Attribution/Share-Alike License 3.0 Unported; prípadne za ďalších
podmienok.
Podrobnejšie informácie nájdete na stránke Podmienky
použitia.
www.astronomia.sk | www.biologia.sk | www.botanika.sk | www.dejiny.sk | www.economy.sk | www.elektrotechnika.sk | www.estetika.sk | www.farmakologia.sk | www.filozofia.sk | Fyzika | www.futurologia.sk | www.genetika.sk | www.chemia.sk | www.lingvistika.sk | www.politologia.sk | www.psychologia.sk | www.sexuologia.sk | www.sociologia.sk | www.veda.sk I www.zoologia.sk