
A | B | C | D | E | F | G | H | CH | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | X | Y | Z | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9

Enzym je jednoduchá či složená bílkovina[pozn. 1] s katalytickou aktivitou. Enzymy určují povahu i rychlost chemických reakcí a řídí většinu biochemických procesů v těle všech živých organismů včetně člověka. Věda o enzymech se jmenuje enzymologie a rozvíjí se zejména od 19. století, kdy si lidé začali všímat procesů, k nimž dochází např. při trávení potravy. Základní složkou enzymů jsou proteiny, na něž se velmi často vážou další přídatné molekuly známé jako kofaktory nebo prostetické skupiny, které se podílí na katalýze. Samotná enzymatická reakce probíhá obvykle v tzv. aktivním místě enzymu. Enzymů je obrovské množství a je možné je klasifikovat do sedmi skupin: oxidoreduktázy, transferázy, hydrolázy, lyázy, izomerázy, ligázy a od roku 2018 i translokázy. Všechny mají společnou katalytickou funkci; vedou reakci jinou reakční cestou, čímž umožňují energeticky méně náročný průběh reakce. Enzymy obecně jsou výrazně specifické a obvykle přeměňují jeden nebo několik málo substrátů, a to jedním definovaným způsobem. Aktivita enzymů, spočívající v ovlivnění rychlosti chemických reakcí snižováním jejich aktivační energie, je závislá zejména na koncentraci substrátu, teplotě, pH a přítomnosti aktivátorů a inhibitorů. Celá řada enzymů již našla praktické využití i v průmyslu a ve výzkumu.
Historie výzkumu

Vědu o enzymech nazýváme enzymologie. Na přelomu 18. a 19. století již existovalo povědomí o procesech, jako je trávení masa žaludeční šťávou[1] nebo rozklad škrobu na jednoduché cukry účinkem slin. Skutečný průběh těchto jevů však byl zahalen tajemstvím a např. pepsin byl objeven až ve století devatenáctém.[2] Velký pokrok v tomto směru představují výzkumy slavného mikrobiologa L. Pasteura, který si povšiml, že pouze živé čerstvé kvasinkové buňky jsou schopné kvasit cukry na alkohol a že tedy tato schopnost je zřejmě nějakým výlučným rysem živých organismů.[3] V té době se však biokatalyzátorům neříkalo enzymy, nýbrž fermenty, protože byly činěny zodpovědnými za rozkladné fermentační procesy v přírodě.[4] V roce 1877 německý fyziolog Wilhelm Kühne poprvé použil slovo „enzym“, které pochází z řeckého ενζυμον, tedy „v kvasinkách (v kvásku, v droždí)“.[pozn. 2] Slovo však bylo v dnešním moderním smyslu používáno až později. O dvacet let později si Eduard Buchner povšiml, že pro kvašení cukru stačí jen kvasinkový extrakt, který zřejmě obsahuje enzym, jenž toto kvašení umožňuje (on tuto látku označoval jako „zymáza“). Za tyto výzkumy mu také bylo udělena Nobelova cena za chemii.[6][7] Stalo se zvykem, že jsou enzymy pojmenovávány podle toho, jakou reakci katalyzují, přidáním koncovky –áza (dříve –asa). Tento úzus zřejmě zavedl francouzský vědec Émile Duclaux, který tak chtěl oslavit objevitele diastázy – prvního izolovaného enzymu vůbec.[8]
Dalším cílem výzkumníků bylo určit biochemickou povahu enzymů. Několik vědců sice poukazovalo na to, že enzymatická aktivita má něco společného s proteiny, ale například vlivný chemik Richard Willstätter tvrdil, že bílkoviny jsou pouhé přenašeče skutečných enzymů a nejsou samy o sobě schopné katalyzovat chemické reakce. James Batcheller Sumner v roce 1924 izoloval a krystalizoval enzym ureázu a prokázal, že se jedná o čistý protein. Důkaz, že proteiny mohou samy o sobě plnit funkci enzymů, podali Northrop a Stanley, kteří zkoumali trávicí enzymy pepsin, trypsin a chymotrypsin. Spolu se Sumnerem jim byla v roce 1946 udělena Nobelova cena za chemii.[9] Díky Sumnerovu objevu krystalizace proteinů se otevřel prostor pro důležitou metodu tzv. rentgenové krystalografie, jenž umožňuje určit prostorovou strukturu bílkovin. Poprvé s touto metodou uspěla skupina vedená D. C. Phillipsem, která v roce 1965 zveřejnila prostorovou strukturu enzymu lysozymu.[10]
Stavba

Základem většiny enzymů je proteinová složka, tzn. dlouhé sekvence aminokyselin vytvářející prostorový útvar. Existuje nicméně i malý počet enzymů, které jsou místo bílkovin složené z RNA – těmto RNA enzymům se říká také ribozymy a patří k nim například rRNA v ribozomu. Menšinovou, ale o to významnější složkou enzymů jsou tzv. prostetické skupiny, které se pevně vážou na enzym a umožňují zpravidla jeho katalytickou funkci. Pouze bílkovinná složka enzymu se označuje apoenzym, který spolu s prostetickou skupinou tvoří výsledný a aktivní holoenzym.[11] Mimo prostetické skupiny se enzymové katalýzy účastní i další, volněji navázané látky, označované obvykle jako koenzymy.
Co se týče terminologie okolo kofaktorů, prostetických skupin a koenzymů, panuje značná nejednotnost. Voet & Voet rozlišují dva druhy kofaktorů, koenzymy a prostetické skupiny, z nichž první se vážou slabě a druhé kovalentně.[11] Stejné pojetí zastává například Vodrážkova Enzymologie[4] nebo Oxford Dictionary of Biochemistry and Molecular Biology.[12] Poněkud jiné definice používá např. Alberts[13] nebo Harper.[14]
Mezi kofaktory se obvykle neřadí další nebílkovinné součási enzymů, jako například různé cukerné složky nebo ionty kovů (protože mnohé enzymy jsou glykoproteiny nebo metaloproteiny). Ke známým metaloenzymům patří metaloproteázy, alkoholdehydrogenáza či karbonáthydrolyáza.[4]
Bílkovinná složka
Hlavní složkou molekul holoenzymů jsou bílkoviny (lineární polypeptidy) složené z 20[pozn. 3] základních proteinogenních α-L-aminokyselin, z nichž každá je svými vlastnostmi odlišná od těch ostatních (ty však platí i pro ostatní proteiny, nejen pro enzymy). Fenylalanin, tryptofan a nepolární alifatické aminokyseliny se například obvykle nachází uvnitř enzymů. Tyrosin nebo histidin bývají poměrně často přítomny v tzv. aktivním centru enzymů, první jmenovaný díky své schopnosti tvořit vodíkové můstky, druhý kvůli schopnosti přijímat protony a svým nukleofilním vlastnostem.[4]
Délkou sahají od pouhých 62 aminokyselin v případě 4-oxalokrotonáttautomerázy[15] po 2500 aminokyselin dlouhý komplex syntázy mastných kyselin.[16] Mnohdy se na stavbě enzymu podílí několik samostatných bílkovin, které dohromady tvoří tzv. proteinový komplex. Pokud se vlivem určitých chemických látek rozruší prostorová struktura enzymů, dojde k tzv. denaturaci, kdy enzym vratně nebo nevratně přestane být funkční. Je tedy zřejmé, že prostorový tvar enzymů je zcela zásadní pro jejich funkčnost – bohužel však stále neumíme podle tvaru molekuly spolehlivě předpovědět druh enzymatické aktivity.[17] Většina enzymů je mnohem větší než látky, jejichž přeměnu katalyzují a na vlastní enzymatické aktivitě se podílí jen např. 3–4 aminokyseliny.[18] Tyto aminokyseliny společně vytváří tzv. aktivní místo. Dalšími důležitými oblastmi v enzymu jsou části, kde se vážou kofaktory nebo jiné malé molekuly potřebné pro katalýzu.
Kofaktory
Některé enzymy ke své funkci potřebují další, nebílkovinné molekuly, jimž se obvykle říká kofaktory. Takových enzymů je dokonce většina, odhaduje se asi 60 %.[4] Kofaktory obecně umožňují přenos jednotlivých atomů nebo elektronů v průběhu enzymatické činnosti.[4] Vymezení a definice jednotlivých druhů kofaktorů se liší autor od autora, nicméně prostetická skupina je obvykle chápána jako pevně vázaná a stabilní součást molekul enzymů, zatímco koenzym se váže pouze slabě a snadno disociuje. Navíc obvykle platí, že koenzymy se obvykle po proběhnutí reakce „spotřebovávají“ a jsou v mnoha případech jiným enzymem opět regenerovány, aby mohly opět plnit svou funkci. V reálné biochemii však existuje plynulý přechod mezi koenzymy a prostetickými skupinami.[4] Podle chemické struktury a funkce je možné všechny kofaktory praktičtěji rozdělit do několika skupin:[4]
- Kofaktory účastnící se oxidačních a redukčních pochodů (kofaktory oxidoreduktáz): patří k nim různé pyridinové (nikotinamidové) (di)nukleotidy (NAD+ a NADP+), flavinové „nukleotidy“ (FMN a FAD), biopterin, lipoová kyselina, benzochinony (CoQ a plastochinon), hem, FeS centra či glutathion.
- Kofaktory umožňující přenos skupin (kofaktory transferáz): patří k nim známý ATP, aktivní sulfát (PAPS), adenosylmethionin a methylkobalamin, tetrahydrofolát, biotin, thiamindifosfát, koenzym A, pyridoxalfosfát, UDP a CDP
- Kofaktory lyáz: patří mezi ně již zmíněné kofaktory, jako acetylkoenzym A, biotin, thiamindifosfát či pyridoxalfosfát
- Kofaktory izomeráz: jsou spíše vzácné, protože izomerázy se bez nich obvykle obejdou; nicméně někdy se používá glutathion nebo různé deriváty kobalaminu
Důležité oblasti
Tvar enzymu může být různý, ale v každém případě by měl zahrnovat tzv. aktivní místo, což je obvykle štěrbina nebo prohlubeň, kde je substrát dostatečně uchráněn před okolním vodným prostředím a může zde dojít ke katalýze. U multimerických enzymů (tedy s více podjednotkami) je aktivní místo mnohdy vytvořeno na pomezí mezi dvěma podjednotkami a na jeho vzniku se tedy podílí aminokyselinové zbytky z dvou či více různých proteinů. V aktivním místě se často nachází různé kofaktory a prostetické skupiny. Jiným důležitým místem je u mnohých (ale zdaleka ne u všech) enzymů tzv. alosterické místo, které se uplatňuje zejména u kaskád několika enzymatických reakcí a je prostředkem tzv. alosterické regulace. Vážou se sem jisté molekuly, přičemž ale nedochází k enzymatické přeměně.[14]
Klasifikace
Mezinárodní biochemická a molekulárně biologická unie (IUBMB) zavedla nomenklaturické rozdělení enzymů pomocí tzv. EC čísel do 7 hlavních kategorií, které se dále dělí na podkategorie. Často se tak můžeme vedle jména enzymu setkat ještě s jeho číselným označením ve stylu např. EC 3.4.11.4. Mezi sedm hlavních kategorií enzymů patří:[4][19]
- EC 1 – oxidoreduktázy: katalyzují oxidačně/redukční reakce
- EC 2 – transferázy: přenášejí funkční skupiny (například methyl-, acetyl- nebo fosfátovou skupinu) mezi substráty
- EC 3 – hydrolázy: katalyzují hydrolýzu chemických vazeb
- EC 4 – lyázy: štěpí chemické vazby jiným způsobem než hydrolýzou či redoxní reakcí
- EC 5 – izomerázy: katalyzují isomerizační reakce
- EC 6 – ligázy: spojují dvě molekuly kovalentní vazbou
- EC 7 – translokázy: zavedena nově v roce 2018 reakce spojená s transportem částic přes membránu (z jedné části buňky do jiné či mezi buňkou a vnějším prostředím)[19]
Tzv. systémové názvy enzymů jsou pokusem o systematické pojmenování enzymů skutečným popisem reakcí, jež katalyzují. Příkladem je třeba (S)-laktát:NAD+-oxidoreduktáza, která katalyzuje oxidoredukční reakci substrátu (S)-laktát se substrátem (resp. kofaktorem) NAD+. V EC systému by její číselný kód zněl EC 1.1.1.27, protože patří do skupiny oxidoreduktáz (1), účinkuje na CH-OH skupinu (1.1), jako akceptor vodíku protonů využívá NAD+ nebo NADP+ (1.1.1) a jedná se o laktátdehydrogenázu (1.1.1.27).[4]
Vlastnosti
Téměř všechny biochemické reakce jsou řízené enzymaticky.[11] Enzymy jsou speciální skupina katalyzátorů, které stojí na pomezí heterogenní a homogenní katalýzy, ale v mnohém připomínají spíše tu heterogenní, ač jsou obvykle rozpuštěné ve vodě. Jsou tak výkonné, že enzymaticky katalyzované reakce dosahují 108–1014× vyšších rychlostí než reakce nekatalyzované.[4] Extrémním příkladem je orotidin-5'-fosfátdekarboxyláza – díky ní reakce, která by trvala 78 milionů let, proběhne s poločasem 18 milisekund.[20] Enzymy předčí svou rychlostí o několik řádů i běžné chemické katalyzátory. Enzymatická reakce má však i celou řadu dalších výhod. Takové reakce se dají obvykle uskutečnit za mnohem nižších teplot, při atmosférickém tlaku a při fyziologickém pH. Dále jsou enzymy velice specifické, mnohem více, než jakýkoliv chemický katalyzátor. Konečně je možné enzym snadno regulovat, například alostericky nebo třeba útlumem syntézy daného proteinu.[11]
Katalýza
Enzymy mění (snižují) aktivační energii. Pozor, enzymy nemění Gibbsovu volnou energii.[21] Snížení aktivační energie výrazně zvyšuje rychlost reakce (stačí poměrně malé snížení energie pro mnohonásobné zvýšení rychlosti).[11] Za vynikající katalytické schopnosti enzymů jsou zodpovědné především čtyři mechanismy. Jednou z možností je, že enzym vhodně přiblíží substráty a vhodně je prostorově orientuje. Vznikne tak vysoká lokální koncentrace substrátů a usnadní se reakce. Jindy se v aktivním místě enzymu vytváří pomocí zbytků vhodných aminokyselin silně kyselé nebo zásadité prostředí podle toho, co je potřeba k proběhnutí reakce. V jiných případech dochází k navázání substrátu na enzym (např. na serin, cystein či histidin[4]) a k natahování nebo rozrušování substrátu, což oslabuje např. cílovou vazbu a usnadňuje rozkladné reakce. Jindy dochází ke katalýze tak, že enzym volí jiný reakční mechanismus, který probíhá snadněji (s nižší aktivační energií), a to obvykle tak, že substrát je dočasně kovalentně navázán samotným enzymem.[14]
Specifita

Enzymy jsou obvykle velmi specifické a obvykle katalyzují zcela konkrétní chemickou reakci, při níž dochází k přeměně substrátu na produkt. Existuje obvykle nejen účinková (reakční) specifita, tedy schopnost enzymu katalyzovat jeden konkrétní typ reakce, ale dále také do jisté míry i substrátová specifita, tedy katalytická aktivita na jeden substrát či na skupinu několika substrátů podobných.[4] Za enzymatickou specifitu je zodpovědný především komplementární tvar substrátu a aktivního místa enzymu, náboj a také hydrofilní a hydrofobní vlastnosti jednotlivých oblastí enzymu a substrátu. Enzymy jsou díky tomu silně geometricky specifické (rozeznávají konkrétní tvar substrátu, na který se vážou) a stereospecifické (působí jen na jeden z enantiomerů).[11] Některé enzymy účastnící se replikace a exprimování DNA (např. 3' 5' exonukleázy) nejen jsou velice přesné, ale ještě po sobě kontrolují vzácné chyby, a tak jsou ve výsledku tak specifické, že činí méně než 1 chybu na 100 milionů enzymatických reakcí.[22][23] Na druhou stranu existují i velmi nespecifické („promiskuitní“) enzymy, jež mohou katalyzovat celou řadu reakcí – příkladem je γ-humulensyntáza z jedle obrovské (Abies grandis), která je za pomoci jednoho substrátu schopna vyrobit 52 různých seskviterpenů.[24]
Na konci 19. století biochemik Emil Fischer navrhl, že substrát přesně zapadá do aktivního centra enzymu.[25] Tato teorie je známa jako hypotéza zámku a klíče. V roce 1958 Koshland vyjádřil přesvědčení,[26] že enzymy se nechovají přesně jako zámek a klíč, ale spíše při vzájemném setkání enzym mění tvar a „zámek a klíč“ se vytvoří teprve v okamžiku, kdy se substrát naváže na enzym. Tato teorie je známa jako hypotéza indukovaného přizpůsobení.[11] Někdy může přizpůsobovat svůj tvar i samotný substrát.[27] Model indukovaného přizpůsobení je zřejmě blíže pravdě než model zámku a klíče, jak ukázala rentgenová difrakční analýza.[11]
Regulovatelnost
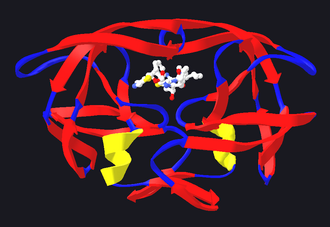
Enzym lze regulovat v zásadě dvěma způsoby, regulací jeho množství a regulací jeho aktivity. Celá řada enzymů není v buňce vůbec či téměř přítomna, dokud nejsou skutečně potřeba (typickým příkladem jsou enzymy v bakteriálním lac operonu). Jiné enzymy je zase možné přestat za jistých okolností vyrábět. V obou případech se jedná o regulaci pomocí navázání na různé regulační sekvence umístěné před geny. Poněkud rychlejší odpovědi buňka dosáhne, pokud zároveň rozloží enzymy již přítomné v buňce.[14]
V případě velmi náhlé (a často dočasné) potřeby se obvykle postupuje cestou regulace aktivity enzymu. To znamená, že enzym je přítomen, ale je (de)aktivován navázáním jistého ligandu (tzv. alosterického regulátoru) či kovalentní modifikací enzymu. Alosterická regulace obvykle zahrnuje určitý druh zpětné vazby: produkt reakce se váže do alosterického místa enzymu a mění jeho aktivitu (inhibuje ho, nebo naopak stimuluje), a to díky změně Michaelisovy konstanty enzymu či limitní rychlosti reakce vmax. Alostericky působí například vazba různých hormonů či druhých poslů na receptor. Z kovalentních modifikací je nejznámější zřejmě fosforylace a defosforylace enzymů (obvykle pomocí kináz a fosfatáz), čímž dochází ke změně aktivity enzymu (buď k jeho spuštění nebo vypnutí).[14] Jiným způsobem aktivace je vyštěpení části proteinu pomocí proteázy, čímž se proenzym (zymogen) změní na aktivní enzym.
Inhibice
Obecně lze rozdělit inhibici na ireverzibilní (nevratnou), která trvale modifikuje molekulu enzymu, a reverzibilní (vratnou), kdy po odstranění inhibitoru např. dialýzou či ultrafiltrací dojde k opětovnému zvýšení aktivity. Ireverzibilní inhibitor se na enzym obvykle váže pevnou kovalentní vazbou, zatímco reverzibilní inhibitor je vázán slabšími interakcemi. Z hlediska mechanismu působení inhibitoru se rozeznávají tři základní typy reverzibilní inhibice. První je tzv. kompetitivní (soutěživá) inhibice, kdy inhibičně působící molekula soutěží se substrátem o vazebné místo na enzymu, ale sama se nedokáže přeměnit na produkt. Zvýšením koncentrace substrátu se dá tomuto typu inhibice do velké míry zabránit. Častější je druhý typ inhibice, tzv. inhibice nekompetitivní, při níž dochází k vazbě inhibitoru na alosterické centrum (tedy nikoliv na aktivní místo) a ke snížení funkceschopnosti enzymu. Změna koncentrace substrátu s takovým typem inhibice nic neudělá. Konečně třetím typem je akompetitivní inhibice, kdy dochází k vazbě inhibitoru na enzym až poté, co byl navázán substrát. To zabraňuje komplexu enzym-substrát, aby provedl enzymatickou reakci. Existuje i celá řada dalších způsobů regulace enzymové aktivity v závislosti na tom, jaké hledisko třídění je použito.[28]
Kinetika

Kinetika zkoumá rychlost chemických reakcí a s ní související záležitosti. Pro enzymovou kinetiku platí obecné zákony chemické kinetiky a uplatňují se v ní běžně známé chemické veličiny, jako je reakční rychlost (v), rovnovážná konstanta (K) či třeba Gibbsova energie (G). Obvykle se vychází ze zjednodušující představy, že enzymem katalyzovaná reakce probíhá ve dvou krocích („E“ je enzym, „S“ je substrát, „P“ je produkt):
načež platí:
Výše uvedená rovnice je tzv. rovnice Michaelise a Mentenové, základní rovnice enzymové kinetiky vůbec. je počáteční rychlost reakce, je mezní rychlost reakce (při nadbytku substrátu a 100% nasycení enzymů), je Michaelisova konstanta a je rovnovážná koncentrace substrátu.[11] Podle uvedené rovnice má závislost reakční rychlosti na koncentraci substrátu má tvar hyperboly. Zajímavou veličinou je Michaelisova konstanta, pro niž platí KM = (k-1 + k2) / k1 a která udává koncentraci substrátu, při níž je reakční rychlost rovna polovině maximální rychlosti.[11] Rovnice Michaelise a Mentenové však je silně zjednodušujícím popisem reality a platila by jen pro počáteční stavy jednosubstrátových reakcí, přičemž by muselo docházet k přímému rozpadu komplexu enzym-substrát na enzym a produkt.[28]
Na rychlost enzymatické reakce (konkrétně na velikost Michaelisovy konstanty) má výrazný vliv řada fyzikálně-chemických vlastností prostředí. Obecně platí, že s vzrůstající teplotou roste rychlost enzymatické reakce až do doby, než se bílkovinná složka enzymu začne denaturovat. Denaturační teplota obvykle u živočišných enzymů činí asi 50–60 °C.[pozn. 4] Na rychlost má dále výrazný vliv pH prostředí – většině enzymů vyhovuje nejlépe pH 5–7, nicméně pepsin má optimum při pH 1,5–2 a argináza při pH 9,5. Aktivitu enzymů dále někdy ovlivňuje redox potenciál, iontová síla a relativní permitivita.[4] Samostatnou kapitolou je vliv inhibitorů a dalších efektorů na průběh enzymatické reakce.
Využitíeditovat | editovat zdroj
Enzymy nalezly celou řadu funkcí i v celé řadě oborů lidské činnosti. Neoddiskutovatelný je jejich význam ve vědě a výzkumu – běžně se využívají různé polymerázy, restrikční endonukleázy, proteázy a podobně. Už několik desetiletí se přidávají enzymy také do pracích prášků, čímž se zvyšuje účinnost odstraňování skvrn i při nižších teplotách. Enzymy šetří energii i v potravinářském, textilním a papírenském průmyslu, v odpadovém hospodářství a podobně. Do budoucna se uvažuje o masivním nasazení enzymů pro výrobu ekologicky šetrných biopaliv.[29] Těmto a dalším aplikacím by mělo usnadnit cestu tzv. enzymové inženýrství.[30]
Proteolytické enzymy se používají například v mlékárenském průmyslu jako syřidla (chymosin) nebo k přípravě hypoalergeního mléka. Enzymy lze využít i ke změkčování masa (papain). Pomocí enzymatického štěpení trisacharidů v luštěninách lze připravit takové luštěniny, které nenadýmají. V analytické chemii lze použít enzymů jako značek na specifickém indikátoru (např. ELISA). Pomocí redoxních enzymů lze poměrně snadno stanovit koncentraci specifického substrátu pro daný enzym. V lékařství lze podávat enzymy jako náhradu chybějících enzymů při poškození slinivky břišní či při léčbě některých onemocnění. Při perorálním podávání enzymů, které mají usnadnit trávení či metabolismus, zpravidla dochází k denaturaci těchto enzymů v žaludku.[31] Denaturaci enzymů v kyselém prostředí žaludku je možno předcházet pomocí vhodné enkapsulace; žaludkem však v takovém případě projde jen několik procent enzymů v původním (nedegradovaném) stavu[32]. Enzymy jsou také využívány při restaurování uměleckých předmětů, převážně malby.[33]
Odkazyeditovat | editovat zdroj
Poznámkyeditovat | editovat zdroj
- ↑ Vzácněji mohou být enzymy nebílkovinné povahy, konkrétně tzv. ribozymy, jež jsou složené z RNA
- ↑ Poprvé zřejmě bylo slovo enzym použito na straně 190 v díle[5] — citováno: „Abych předešel nedorozumění a složitým větným konstrukcím, navrhuji termín enzym…“
- ↑ Počet proteinogenních aminokyselin není vůbec ustálen, ačkoliv obvykle se uvádí 20 základních. Nicméně v určitých případech může být za proteinogenní považován i 21. selenocystein, příp. 22. pyrolysin. Naopak prolin je spíše iminokyselina, a tak by správně mezi aminokyseliny vůbec neměl být počítán.
- ↑ Nicméně se také uvádí, že teplotní optimum bílkovin je jen o málo vyšší, než tělesná teplota.[14]
Referenceeditovat | editovat zdroj
V tomto článku byl použit překlad textu z článku enzyme na anglické Wikipedii.
- ↑ DE RÉAUMUR, RAF. Observations sur la digestion des oiseaux. Histoire de l'academie royale des sciences. 1752, roč. 1752, s. 266, 461.
- ↑ WILLIAMS, H. S. A History of Science: in Five Volumes. Volume IV: Modern Development of the Chemical and Biological Sciences. s.l.: Harper and Brothers (New York), 1904. Dostupné online.
- ↑ DUBOS, J. Louis Pasteur: Free Lance of Science, Gollancz. Quoted in Manchester K. L. (1995) Louis Pasteur (1822–1895) — chance and the prepared mind. Trends Biotechnol. 1951, roč. 13, čís. 12, s. 511–5. Dostupné online. DOI 10.1016/S0167-7799(00)89014-9. PMID 8595136.
- ↑ a b c d e f g h i j k l m n VODRÁŽKA, Zdeněk; RAUSCH, Pavel; KÁŠ, Jan. Enzymologie. s.l.: VŠCHT v Praze, 1998.
- ↑ KÜHNE, Wilhelm. Über das Verhalten verschiedener organisirter und sog. ungeformter Fermente. Verhandlungen des naturhistorisch-medicinischen Vereins zu Heidelberg. 1877, roč. 1, čís. 3, s. 190–193. Dostupné online.
- ↑ Nobel Laureate Biography of Eduard Buchner online. http://nobelprize.org. Dostupné online.
- ↑ BUCHNER, Eduard. Cell-free fermentation - Nobel Lecture online. 11. prosinec 1907. Dostupné online.
- ↑ DUCLAUX, Emile. Traité de Microbiologie. Svazek 2. Paris, Francie: Masson and Co., 1899. Dostupné online. Kapitola 1, s. 9.
- ↑ 1946 Nobel prize for Chemistry laureates online. http://nobelprize.org cit. 2010-12-12. Dostupné online.
- ↑ Blake CC, Koenig DF, Mair GA, North AC, Phillips DC, Sarma VR. Structure of hen egg-white lysozyme. A three-dimensional Fourier synthesis at 2 Angstrom resolution. Nature. 1965, roč. 22, čís. 206, s. 757–61. DOI 10.1038/206757a0. PMID 5891407.
- ↑ a b c d e f g h i j VOET, Donald; VOET, Judith. Biochemie. 1.. vyd. Praha: Victoria Publishing, 1995. ISBN 80-85605-44-9.
- ↑ Oxford dictionary of biochemistry and molecular biology; revised edition. Příprava vydání R. Cammack et al. New York: Oxford university press, 2006. ISBN 0-19-852917-1.
- ↑ ALBERTS, Bruce , et al. The Molecular Biology of the Cell. s.l.: Garland Science, 2002. (4th. ed). Dostupné online. ISBN 0-8153-3218-1.
- ↑ a b c d e f MURRAY, Robert K., Daryl K. Granner, Peter A. Mayes, Victor W. Rodwell. Harper's Illustrated Biochemistry. s.l.: Lange Medical Books/McGraw-Hill; Medical Publishing Division, 2003. ISBN 0-07-138901-6.
- ↑ Chen LH, Kenyon GL, Curtin F, Harayama S, Bembenek ME, Hajipour G, Whitman CP. 4-Oxalocrotonate tautomerase, an enzyme composed of 62 amino acid residues per monomer. J. Biol. Chem.. 1992, roč. 267, čís. 25, s. 17716–21. PMID 1339435.
- ↑ Smith S. The animal fatty acid synthase: one gene, one polypeptide, seven enzymes. FASEB J.. 1 December 1994, roč. 8, čís. 15, s. 1248–59. Dostupné online. PMID 8001737.
- ↑ Dunaway-Mariano D. Enzyme function discovery. Structure. 2008, roč. 16, čís. 11, s. 1599–600. DOI 10.1016/j.str.2008.10.001. PMID 19000810.
- ↑ The Catalytic Site Atlas at The European Bioinformatics Institute online. cit. 2012-06-07. Dostupné v archivu pořízeném dne 2013-08-03.
- ↑ a b http://enzyme-database.org/downloads/ec7.pdf
- ↑ RADZICKA, A.; WOLFENDEN, R. A proficient enzyme. Science.. 1995, roč. 267, čís. 5194, s. 90–3. Dostupné online. ISSN 0036-8075.
- ↑ Mechanisms. Biology LibreTexts online. 2013-11-21 cit. 2021-03-10. Dostupné online. (anglicky)
- ↑ Shevelev IV, Hubscher U. The 3' 5' exonucleases. Nat Rev Mol Cell Biol.. 2002, roč. 3, čís. 5, s. 364–76. DOI 10.1038/nrm804. PMID 11988770.
- ↑ Tymoczko, John L.; Stryer Berg Tymoczko; Stryer, Lubert; Berg, Jeremy Mark. Biochemistry. San Francisco: W.H. Freeman, 2002. Dostupné online. ISBN 0-7167-4955-6.
- ↑ YOSHIKUNI, Y.; FERRIN, T. E.; KEASLING, J. D. Designed divergent evolution of enzyme function. Nature.. 2006, roč. 440, čís. 7087, s. 1078–82. ISSN 1476-4687.
- ↑ Fischer E. Einfluss der Configuration auf die Wirkung der Enzyme. Ber. Dt. Chem. Ges.. 1894, roč. 27, s. 2985–93. Dostupné online. DOI 10.1002/cber.18940270364.
- ↑ Koshland D. E. Application of a Theory of Enzyme Specificity to Protein Synthesis. Proc. Natl. Acad. Sci.. 1958, roč. 44, čís. 2, s. 98–104. DOI 10.1073/pnas.44.2.98. PMID 16590179.
- ↑ Vasella A, Davies GJ, Bohm M. Glycosidase mechanisms. Curr Opin Chem Biol.. 2002, roč. 6, čís. 5, s. 619–29. DOI 10.1016/S1367-5931(02)00380-0. PMID 12413546.
- ↑ a b VODRÁŽKA, Zdeněk. Biochemie. Praha: Academia, 2007. ISBN 978-80-200-0600-4.
- ↑ Enzymy proti klimatickým změnám online. OSEL.cz, 8. 12. 2010. Zřejmě založeno na 1. Dostupné online.
- ↑ Chemists Create 'Designer Enzymes' online. Medical News Today, 2008 cit. 2011-04-24. Dostupné v archivu pořízeném dne 2009-10-02.
- ↑ ROSS, Don. Food and Nutrition. Jaipur, Indie: Oxford Book Company, 2010. ISBN 978-93-80179-13-1.
- ↑ NOUZA, K.; WALD, M. Systemic enzyme therapy: problems of resorption of enzyme macromolecules. Casopis Lekaru Ceskych. 1995-10-04, roč. 134, čís. 19, s. 615–619. PMID 7585873. Dostupné online cit. 2017-01-17. ISSN 0008-7335. PMID 7585873.
- ↑ TOMALOVÁ, Iva. Využití enzymů v restaurátorské praxi. Brno, 2008. 32 s. Bakalářská práce. Přírodovědecká fakulta Masarykovy univerzity. Vedoucí práce Igor Fogaš. Dostupné online.
Literaturaeditovat | editovat zdroj
- VODRÁŽKA, Zdeněk. Biochemie. Praha: Academia, 2007. ISBN 978-80-200-0600-4.
- VODRÁŽKA, Zdeněk; RAUSCH, Pavel; KÁŠ, Jan. Enzymologie. s.l.: VŠCHT v Praze, 1998.
- VOET, Donald; VOET, Judith. Biochemie. 1.. vyd. Praha: Victoria Publishing, 1995. ISBN 80-85605-44-9.
- MURRAY, Robert K., et al. Harperova biochemie. Překlad Jiří Kraml et al.. 4. v ČR. vyd. Praha: H & H, 2002. 872 s s. ISBN 80-7319-013-3.
Externí odkazyeditovat | editovat zdroj
 Obrázky, zvuky či videa k tématu enzym na Wikimedia Commons
Obrázky, zvuky či videa k tématu enzym na Wikimedia Commons  Slovníkové heslo enzym ve Wikislovníku
Slovníkové heslo enzym ve Wikislovníku- BRENDA — comprehensive compilation of information and literature references about all known enzymes
- Podrobná klasifikace enzymů
Text je dostupný za podmienok Creative Commons Attribution/Share-Alike License 3.0 Unported; prípadne za ďalších podmienok. Podrobnejšie informácie nájdete na stránke Podmienky použitia.
Íránské revoluční gardy
Úřad OSN pro palestinské uprchlíky na Blízkém východě
Úřad pro koordinaci humanitárních záležitostí
Útok Íránu na Izrael (2024)
Území okupovaná Izraelem
Časová osa ruské invaze na Ukrajinu (2024)
Časová osa války Izraele s Hamásem (2023)
Česká ženská hokejová reprezentace do 18 let
Česká Wikipedie
Česko
Čestný doktorát
Šabat
Šestá vláda Benjamina Netanjahua
Šestidenní válka
Šin bet
Špionáž
Švýcarsko
Železná kopule
Ženevské úmluvy
14. leden
15. leden
16. květen
16. leden
18. leden
19. leden
1916
1924
1964
1973
1978
1984
2009
2014
29. leden
30. květen
904
Abú Ubajda
Abdikace
Aharon Kacir
Amal
Americká ženská hokejová reprezentace do 18 let
Aminokyselina
Amnesty International
Amnon Rubinstein
António Guterres
Antigen
Antony Blinken
Aríš
Arabština
Arno Allan Penzias
B'Tselem
Bílý fosfor
Bílkovina
Břetislav Tureček
Bajt Hanún
Bandikutovití dvouprstí
BBC
Be'eri
Benjamin Netanjahu
Bikáa
Binjamin Ganc
Biochemie
Biofyzika
Biologická makromolekula
Biotechnologie
Blokáda Pásma Gazy
Brigády Abú Alího Mustafy
Brigády Izz ad-Dína al-Kassáma
Brigády mučedníků Al-Aksá
Britský mandát Palestina
Carlos Sainz
Carl Andre
Chán Júnis
Cholit
CNN
Commons:Featured pictures/cs
Dánsko
Dětský fond Organizace spojených národů
Dženín
Damašek
Dauhá
David Barnea
Demokratická fronta pro osvobození Palestiny
Den lidských práv
Druhá intifáda
Efrajim Kacir
Egypt
Elektrochemie
Encyklopedie
Enzym
Enzymové inženýrství
Fatah
Fosfor
Frank-Walter Steinmeier
Frank Farian
Frederik X.
Gary Graham
Gaza
Genetický kód
Glatiramer-acetát
Grindavík
Hútíové
Hakan Fidan
Hamás
Hasan Nasralláh
Hebrejština
Herci Halevi
Hizballáh
Hladomor v Pásmu Gazy
Hlavní strana
Hromadný hrob
Human Rights Watch
Imunitní reakce
Infekční onemocnění
Innsbruck
Irák
Irbíl
Isfahán
Islámský stát
Island
Ismáíl Haníja
Istanbul
Izrael
Izraelští Arabové
Izraelci
Izraelská blokáda Pásma Gazy (2023–2024)
Izraelská blokáda Pásma Gazy (2023)
Izraelská hraniční policie
Izraelská policie
Izraelské obranné síly
Izraelské osady
Izraelské pozemní síly
Izraelské vojenské letectvo
Izraelské vojenské námořnictvo
Izraelský útok na íránský konzulát v Damašku
Izraelský plán jednostranného stažení
Izraelsko-palestinské střety (květen 2021)
Izraelsko-palestinské střety (srpen 2022)
Jahjá Sinvár
Jana Černochová
Janbú
Japonsko
JAXA
Jemen
Jeruzalémské brigády
Jiří Bičák
Jižní Korea
Jicchak Herzog
Jicchak Navon
Jo'av Galant
Joe Biden
Jomkipurská válka
Josep Borrell
Kabinet Spojených států amerických
Katáib Hizballáh
Katar
Kategorie:Čas
Kategorie:Články podle témat
Kategorie:Život
Kategorie:Dorozumívání
Kategorie:Geografie
Kategorie:Historie
Kategorie:Hlavní kategorie
Kategorie:Informace
Kategorie:Kultura
Kategorie:Lidé
Kategorie:Matematika
Kategorie:Příroda
Kategorie:Politika
Kategorie:Právo
Kategorie:Rekordy
Kategorie:Seznamy
Kategorie:Společnost
Kategorie:Sport
Kategorie:Technika
Kategorie:Umění
Kategorie:Věda
Kategorie:Vojenství
Kategorie:Vzdělávání
Kategorie:Zdravotnictví
Kerem Šalom
Kfar Aza
Kibuc
Kim Čong-un
Kobi Šabtaj
Korunní princ Saúdské Arábie
Kosmodrom Si-čchang
Kostel svatého Porfyria
Krize v Rudém moři
Kyjev
Láva
Lékaři bez hranic
Letadlová loď
Libanon
Lidová fronta pro osvobození Palestiny
Lidová fronta pro osvobození Palestiny - Hlavní velení
Lockheed Martin
Lockheed Martin X-59 QueSST
Luigi Nono
Luigi Riva
Luis Tejada
Lví doupě
Měsíc
Magen
Magnetické pole
Mahmúd Abbás
Markéta II.
Markéta Pekarová Adamová
Martin Macík
Masakr na hudebním festivalu v Re'im
Masakr na letišti Lod
Mešita
Mešita al-Aksá
Melanie Safka
Mezinárodní červený kříž
Mezinárodní federace novinářů
Mezinárodní soudní dvůr
Mezinárodní trestní soud
Micheál Martin
Milan Stanislav Ďurica
Miloš Zeman
Mistrovství světa v ledním hokeji žen do 18 let
Monarchie v Dánsku
Mosad
Moskva
Muhammad bin Salmán
Muhammad Dajf
Náblus
Nájif Hawátma
Nápověda:Úvod
Nápověda:Úvod pro nováčky
Nápověda:Obsah
Německo
Nachal Oz
Nadžíb Míkátí
Nadace Wikimedia
NASA
Nemocnice Šífa
Netiv ha-Asara
Nicolaas Henneman
Nirim
Nir Am
Nir Jicchak
Nir Oz
Norbert Lichý
Ofakim
Oliva
Olivovník
Operace Štít a šíp
Operace Domov a zahrada
Operace Lité olovo
Operace Ochranné ostří
Operace Prosperity Guardian
Organizace spojených národů
Otto Herschmann
Oxfam
Pákistán
Pásmo Gazy
Palestina
Palestinská autonomie
Palestinský islámský džihád
Palmovka
Petr Pavel
Portál:Aktuality
Portál:Doprava
Portál:Geografie
Portál:Historie
Portál:Kultura
Portál:Lidé
Portál:Náboženství
Portál:Obsah
Portál:Příroda
Portál:Sport
Preemptivní válka
Premiér Izraele
Prozatímní jednotky OSN v Libanonu
První arabsko-izraelská válka
Q122962941
Rada bezpečnosti OSN
Rafah
Rakovina
Rallye Dakar 2024
Ramadán
Re'im
Recep Tayyip Erdoğan
Rechovot
Reuters
Reykjanes
Ronen Bar
Roztroušená skleróza
Ruská invaze na Ukrajinu
Sálih Arúrí
Sístán a Balúčistán
Sýrie
Saúdská Arábie
SA-5
Sabra
Saturn I
Sderot
Sergius III.
Severní Korea
Seznam představitelů Ukrajiny#Chronologický přehled prezidentů od roku 1991
Seznam prezidentů České republiky
Seznam prezidentů Izraele
Shawnacy Barber
Simchat Tóra
SLIM
Slunce
Sluneční erupce
Solar Dynamics Observatory
Soubor:Air Force Ensign of Israel.svg
Soubor:Attacks on U.S. bases in Iraq and Syria (2023–present).svg
Soubor:August 2010 CME SDO Multi-Wavelength.jpg
Soubor:Damage in Gaza Strip during the October 2023 - 13.jpg
Soubor:Damage in Gaza Strip during the October 2023 - 29.jpg
Soubor:Damage in Gaza Strip during the October 2023 - 36.jpg
Soubor:Damage in Gaza Strip during the October 2023 - 41.jpg
Soubor:Dorothy Malone - Peyton Place.jpg
Soubor:EKatzir771.jpg
Soubor:Flag of Israel.svg
Soubor:Flag of Mossad.svg
Soubor:Flag of the Al-Nasser Salah al-Deen Brigades.svg
Soubor:Flag of the Amal Movement.svg
Soubor:Flag of the Democratic Front for the Liberation of Palestine.svg
Soubor:Flag of the Israeli Army (Land Arm) Gray.svg
Soubor:Flag of the Israel Border Police.svg
Soubor:Flag of the Israel Defense Forces.svg
Soubor:Flag of the Israel Police.svg
Soubor:Flag of the Muslim Brotherhood.png
Soubor:Flag of the Syrian Social Nationalist Party.svg
Soubor:Gaza envelope after coordinated surprise offensive on Israel, October 2023 (KBG GPO06).jpg
Soubor:Gaza envelope after coordinated surprise offensive on Israel, October 2023 (KBG GPO11).jpg
Soubor:Isaac Herzog at Ben Gurion Airport, October 2023 (ABG 4491).jpg
Soubor:Isaac Herzog in Beit HaNassi, November 2023 (ABG 1660).jpg
Soubor:Miss Mitford's Dog.png
Soubor:Naval Ensign of Israel.svg
Soubor:Occupied Palestinian Territories.jpg
Soubor:PFLP-GC Flag.svg
Soubor:Photos of Israelis who were kidnapped by Hamas during the October 7 attack IMG 6972.JPG
Soubor:Red flag.svg
Soubor:Single Color Flag - FFFF00.svg
Soubor:SoI--IDF-Negev-NG7.jpg
Soubor:SoI-War 23-10-29 IDF 01-11.jpg
Soubor:SoI-War 23-11-01 IDF 13-04.jpg
Soubor:The USS Dwight D. Eisenhower and USS USS Gerald R. Ford carrier strike groups in November 2023.jpg
Soubor:UN Resolution regarding the 2023 Israel–Hamas war 2.svg
Speciální:Kategorie
Speciální:Nové stránky
Speciální:Statistika
Spojené království
Spojené státy americké
Sputnik (plastika)
Světový potravinový program
Svartsengi
Túlkarim
TASS
The Guardian
The Times of Israel
The Washington Post
Ukrajina
Ultrafialová fotografie
Urim
USS Dwight D. Eisenhower (CVN-69)
USS Gerald R. Ford
Válečná vláda Izraele
Válečný zločin
Válka
Válka Izraele s Hamásem (2023–2024)
Vinzenz Malik
Vláda Bohuslava Sobotky
Volodymyr Zelenskyj
Weizmannův institut věd
Wiki
Wikicitáty:Hlavní strana
Wikidata:Hlavní strana
Wikifunctions:Main Page
Wikiknihy:Hlavní strana
Wikimedia Česká republika
Wikipedie:Údržba
Wikipedie:Časté chyby
Wikipedie:Často kladené otázky
Wikipedie:Článek týdne
Wikipedie:Článek týdne/2024
Wikipedie:Citování Wikipedie
Wikipedie:Dobré články
Wikipedie:Dobré články#Portály
Wikipedie:Kontakt
Wikipedie:Nejlepší články
Wikipedie:Obrázek týdne
Wikipedie:Obrázek týdne/2024
Wikipedie:Ověřitelnost
Wikipedie:Požadované články
Wikipedie:Pod lípou
Wikipedie:Portál Wikipedie
Wikipedie:Potřebuji pomoc
Wikipedie:Průvodce
Wikipedie:Seznam jazyků Wikipedie
Wikipedie:Velvyslanectví
Wikipedie:Vybraná výročí dne/leden
Wikipedie:Vyhněte se vyhýbavým slovům#Příklady
Wikipedie:WikiProjekt Kvalita/Články k rozšíření
Wikipedie:Zajímavosti
Wikipedie:Zajímavosti/2024
Wikipedie:Zdroje informací
Wikislovník:Hlavní strana
Wikiverzita:Hlavní strana
Wikizdroje:Hlavní strana
Wikizprávy:Hlavní strana
World Central Kitchen
Západní břeh Jordánu
Zijád an-Nachaláh
Zimní olympijské hry 1964
Text je dostupný za podmienok Creative
Commons Attribution/Share-Alike License 3.0 Unported; prípadne za ďalších
podmienok.
Podrobnejšie informácie nájdete na stránke Podmienky
použitia.
www.astronomia.sk | www.biologia.sk | www.botanika.sk | www.dejiny.sk | www.economy.sk | www.elektrotechnika.sk | www.estetika.sk | www.farmakologia.sk | www.filozofia.sk | Fyzika | www.futurologia.sk | www.genetika.sk | www.chemia.sk | www.lingvistika.sk | www.politologia.sk | www.psychologia.sk | www.sexuologia.sk | www.sociologia.sk | www.veda.sk I www.zoologia.sk






