A | B | C | D | E | F | G | H | CH | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | X | Y | Z | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9

Fenylová skupina, skrátene fenyl, označuje v organickej chémii cyklickú skupinu, ktorej vzorec je –C6H5. Často je reprezentovaná symbolom Ph (z anglického phenyl). Nazýva sa i fenylový zvyšok alebo fenylové jadro.[1][2] Fenylová skupina je veľmi blízka benzénu a je možné ju vnímať ako benzénové jadro bez jedného atómu vodíka, ktorý možno nahradiť iným prvkom alebo zlúčeninou, takže sa z fenylu stáva funkčná skupina. Fenylová skupina má šesť atómov uhlíka usporiadaných do planárneho šesťuholníka, pričom päť z týchto uhlíkových atómov má naviazaných po jednom vodíku a posledný uhlíkový atóm je naviazaný na substituent. Fenylová skupina je bežná v organickej chémii.[3] Aj keď je často zobrazovaná so striedajúcimi sa jednoduchými a dvojitými väzbami, táto skupina je v skutočnosti aromatická a všetky väzby medzi uhlíkmi sú v rámci kruhu rovnako dlhé.[3][4] Táto skupina patrí medzi aryly.[5]
Názov
Názov fenylová skupina je synonymom skupiny –C6H5 a niekedy sa označuje ako Ph alebo archaicky ako Φ (grécke fí). Benzén sa niekedy zapisuje ako PhH. Fenylová skupina je zvyčajne viazané na iné atómy alebo skupiny. V prípade trifenylmetánu, Ph3CH, sú tri fenylové skupiny viazané na jeden atóm uhlíka.[6] Mnohé alebo dokonca väčšina fenylových skupín sa neoznačuje ako „fenyl“. Napríklad zlúčenina, ktorej vzorec je C6H5Cl, sa bežne označuje ako chlórbenzén, aj keď ho možno označiť ako fenylchlorid. V špeciálnych prípadoch je fenyl možné izolovať či detegovať v podobe fenylového aniónu (C6H5−), fenylového katiónu (C6H5+) a fenylového radikálu (C6H5•).[chýba zdroj
Aj keď názov fenyl a symbol Ph označujú konkrétne skupinu –C6H5, niektoré substituované deriváty sa označujú obdobnými názvami. Skupina –C6H4NO2 sa napríklad označuje ako nitrofenyl a skupina –C6F5 sa označuje ako pentafluórfenyl. Monosubstituované fenylové skupiny (teda disubstituované benzény) sú asociované s elektrofilnou aromatickou substitúciou a produkty vznikajú podľa substitučných vzorov arénov. Substituovaný fenyl má teda tri izoméry – orto (1,2-disubstituovaný), meta (1,3-disubstituovaný) a para (1,4-disubstituovaný). Disubstituovaný fenyl (teda trisubstituovaný benzén) môže byť substituovaný napríklad v polohách 1,2,3 a v polohách 1,3,5. Viacsubstituované fenyly, ako je pentafluórfenyl, existujú a pomenovávajú sa podľa názvoslovia IUPAC.[chýba zdroj
Etymológia
Názov fenyl je odvodený z francúzskeho phényle, ktoré pochádza z gréckeho φαίνω, phaino, „svietiaci“, keďže prvé fenylové zlúčeniny vznikali ako vedľajšie produkty pri výrobe a čistení rôznych plynov používaných pri osvetlení.[7] Podľa McMurryho je toto slovo odvodené od gréckeho pheno, „nesiem svetlo“, čo odkazuje na objav benzénu, ktorý učinil Michael Faraday v roku 1825 olejnatého zvyšku, ktorý ostal v londýnskom pouličnom osvetlení.[8]
Štruktúra
Fenylové zlúčeniny sú formálne odvodené od benzénu, často potom i pri spôsobe ich prípravy. Čo sa týka elektronických vlastností, fenylová skupina je príbuzná vinylovej skupine. Všeobecne má záporný indukčný efekt (I-) kvôli vyššej elektronegativite sp2 hybridizovaných uhlíkových atómov a kladný mezomérny efekt (M+) vďaka schopnosti delokalizovaného pí systému darovať elektróny, ak je možná konjugácia.[9] Fenylová skupina je hydrofóbna a typicky je odolná voči oxidácii a redukcii. Fenylové skupiny (tak ako všetky aromatické zlúčeniny) majú zvýšenú stabilitu oproti ekvivalentným väzbám v alifatických (nearomatických) zlúčeninách. Táto stabilita vychádza z jedinečných vlastností aromatických molekulárnych orbitálov.[4]
Väzbová dĺžka väzieb C–C je asi 1,4 Å.[10]
V 1H-NMR spektroskopii sa chemický posun protónov fenylovej skupiny nachádza zvyčajne okolo 7,2-7,4 ppm. Tieto chemické posuny sú ovplyvnené prúdom aromatického jadra a môžu sa meniť v závislosti na naviazaných substituentoch.[11]
Príprava
Na naviazanie fenylovej skupiny na nejakú chemickú látku sa zvyčajne používajú činidlá, ktoré poskytujú fenylový anión alebo fenylový katión. Medzi tieto zlúčeniny patrí napríklad fenyllítium (C6H5Li) a fenylmagnéziumbromid (C6H5MgBr). Benzén potom atakuje elektrofily, čím vznikajú fenylované deriváty:
- C6H6 + E+ → C6H5E + H+
kde E+ („elektrofil“) = Cl+, NO2+, SO3. Tieto reakcie patria medzi elektrofilné aromatické substitúcie.[chýba zdroj
Zlúčeniny
Fenylová skupina je súčasťou mnohých organických zlúčenín, či už prírodných alebo syntetických. Medzi bežné prírodné látky s touto skupinou patrí aminokyselina fenylalanín.[12]
Jeden z hlavných produktov petrochemického priemyslu je BTX, ktoré sa skladá z benzénu, toluénu a xylénu, ktoré sa používajú ako základné stavebné bloky pre fenylové zlúčeniny.[13]
Polymér polystyrén je odvodený od monoméru obsahujúceho fenylovú skupinu (styrénu) a väčšina jeho vlastností vzniká práve kvôli rigidite a hydrofobicite fenylovej skupiny.[14]
Mnoho liekov a i mnoho polutantov obsahuje fenylovú skupinu.
Jedna z najjednoduchších zlúčenín s touto skupinou je fenol, C6H5OH. Hovorí sa, že rezonančná stabilizácia robí z fenolu silnejšiu kyselinu oproti alifatickým alkoholom ako je napríklad etanol (pKa = 10 vs. 16-18). Významný príspevok ku kyslosti fenolu však má i väčšia elektronegativita sp2 alfa uhlíku na fenole oproti sp3 alfa uhlíku alifatických alkoholov.[15]
- Reprezentatívne zlúčeniny s fenylovou skupinou
-
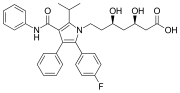
Atorvastatín (Lipitor) je liek, ktorý obsahuje dve fenylové skupiny a jednu p-fluórfenylovú skupinu. Používa sa na zníženie hladiny cholesterolu u ľudí s hypercholesterolémiou.
-
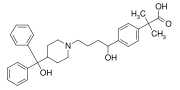
Fexofenadín (Allegra, Telfast) je liek, ktorý má difenylmetylovú skupinu a p-fenylénovú skupinu (C6H4). Je to antihistaminikum používané pri liečbe alergií.
-
Fenylalanín, jedna z proteinogénnych aminokyselín.
-
Bifenyl sa skladá z dvoch fenylových skupín. Tieto kruhy zvyčajne nie sú koplanárne (neležia v tej istej rovine).
-
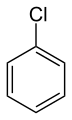
Chlórbenzén sa používa ako rozpúšťadlo.
Referencie
- ↑ benzilový prešmyk. In: BÍNA, Jaroslav. Malá encyklopédia chémie. Bratislava : Obzor, 1981. S. 136.
- ↑ Curtiov—Hammettov princíp. In: BÍNA, Jaroslav. Malá encyklopédia chémie. Bratislava : Obzor, 1981. S. 168.
- ↑ a b MARCH, Jerry. Advanced organic chemistry: reactions, mechanisms, and structure. 4th. vyd. New York : Wiley, 1992. Dostupné online. ISBN 978-0-471-60180-7.
- ↑ a b Aromaticity. Benzene and Other Aromatic Compounds . Michigan State University. Dostupné online.
- ↑ aryl. In: BÍNA, Jaroslav. Malá encyklopédia chémie. Bratislava : Obzor, 1981. S. 118.
- ↑ trifenylmetán. In: BÍNA, Jaroslav. Malá encyklopédia chémie. Bratislava : Obzor, 1981. S. 675.
- ↑ phenyl . . Dostupné online. Archivované 2013-02-16 z originálu.
- ↑ MCMURRY, John E.. Organic Chemistry, Enhanced Edition. : Cengage Learning, 2009. Dostupné online. ISBN 9781111790042. S. 518. (po anglicky)
- ↑ HANSCH, Corwin.; LEO, A.; TAFT, R. W.. A survey of Hammett substituent constants and resonance and field parameters. Chemical Reviews, 1991-03-01, s. 165–195. ISSN 0009-2665. DOI: 10.1021/cr00002a004.
- ↑ Computation of the structures of the phenyl and benzyl radicals with the UHF method. The Journal of Organic Chemistry, 1987, s. 5025–5026. ISSN 0022-3263. DOI: 10.1021/jo00231a035.
- ↑ HU, Kai; WU, Xiaojun; SHEN, Junfeng. 1H NMR spectrum simplification of phenyl compounds containing electronegative groups by intermolecular interactions. Tetrahedron Letters, 2008-03-31, roč. 49, čís. 14, s. 2324–2328. Dostupné online . ISSN 0040-4039. DOI: 10.1016/j.tetlet.2008.01.111. (po anglicky)
- ↑ ŠKÁRKA, Bohumil; FERENČÍK, Miroslav. Biochémia. 3. vyd. : , 1992. ISBN 80-05-01076-1. S. 268.
- ↑ Benzene/Toluene Archivované 2011-08-31 na Wayback Machine. Introduction to a ChemSystems report, 2009.
- ↑ John Scheirs; Duane Priddy. Modern Styrenic Polymers: Polystyrenes and Styrenic Copolymers. : John Wiley & Sons, 28 March 2003. Dostupné online. ISBN 978-0-471-49752-3. S. 3.
- ↑ Inductive and Resonance Effects on the Acidities of Phenol, Enols, and Carbonyl α-Hydrogens. The Journal of Organic Chemistry, 2009, s. 914–916. ISSN 0022-3263. DOI: 10.1021/jo8018736. PMID 19053615.
Zdroj
Tento článok je čiastočný alebo úplný preklad článku Phenyl group na anglickej Wikipédii.
Text je dostupný za podmienok Creative Commons Attribution/Share-Alike License 3.0 Unported; prípadne za ďalších podmienok. Podrobnejšie informácie nájdete na stránke Podmienky použitia.
Antropológia
Aplikované vedy
Bibliometria
Dejiny vedy
Encyklopédie
Filozofia vedy
Forenzné vedy
Humanitné vedy
Knižničná veda
Kryogenika
Kryptológia
Kulturológia
Literárna veda
Medzidisciplinárne oblasti
Metódy kvantitatívnej analýzy
Metavedy
Metodika
Text je dostupný za podmienok Creative
Commons Attribution/Share-Alike License 3.0 Unported; prípadne za ďalších
podmienok.
Podrobnejšie informácie nájdete na stránke Podmienky
použitia.
www.astronomia.sk | www.biologia.sk | www.botanika.sk | www.dejiny.sk | www.economy.sk | www.elektrotechnika.sk | www.estetika.sk | www.farmakologia.sk | www.filozofia.sk | Fyzika | www.futurologia.sk | www.genetika.sk | www.chemia.sk | www.lingvistika.sk | www.politologia.sk | www.psychologia.sk | www.sexuologia.sk | www.sociologia.sk | www.veda.sk I www.zoologia.sk