A | B | C | D | E | F | G | H | CH | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | X | Y | Z | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9
| Chlorid kremičitý | |||||||||||||||||||||||||||||||||||||
| | |||||||||||||||||||||||||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||||||||||||||||||||||||
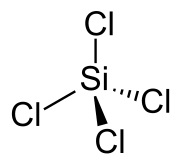
| Sumárny vzorec | SiCl4 | ||||||||||||||||||||||||||||||||||||
| Synonymá | Tetrachlórsilán | ||||||||||||||||||||||||||||||||||||
| Vzhľad | bezfarebná dymiaca kvapalina | ||||||||||||||||||||||||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||||||||||||||||||||||||
| Molekulová hmotnosť | 169,9 u | ||||||||||||||||||||||||||||||||||||
| Molárna hmotnosť | 169,89 g/mol | ||||||||||||||||||||||||||||||||||||
| Teplota topenia | −68,74 °C | ||||||||||||||||||||||||||||||||||||
| Teplota varu | 57,65 °C | ||||||||||||||||||||||||||||||||||||
| Kritický bod | 232,8 °C, 3 750 kPa, 0,584 g/cm³ | ||||||||||||||||||||||||||||||||||||
| Hustota | 1,470 7 g/cm³ 1,483 g/cm³ (20 °C) 0,007 g/cm³ (plyn) | ||||||||||||||||||||||||||||||||||||
| Rozpustnosť | vo vode: rozkladá sa v polárnych rozpúšťadlách: étery reaguje s alkoholmi v nepolárnych rozpúšťadlách: chlórované uhľovodíky aromatické uhľovodíky | ||||||||||||||||||||||||||||||||||||
| Termochemické vlastnosti | |||||||||||||||||||||||||||||||||||||
| Entropia topenia | 45,4 J/g | ||||||||||||||||||||||||||||||||||||
| Entropia varu | 168,5 J/g | ||||||||||||||||||||||||||||||||||||
| Štandardná zlučovacia entalpia | −640,3 kJ/mol (kvapalina) −609,6 kJ/mol (plyn) | ||||||||||||||||||||||||||||||||||||
| Štandardná entropia | 239 J K−1 mol−1 (kvapalina) 331 J K−1 mol−1 (plyn) | ||||||||||||||||||||||||||||||||||||
| Štandardná Gibbsová energia | −572,9 kJ/mol (kvapalina) −570,1 kJ/mol (plyn) | ||||||||||||||||||||||||||||||||||||
| Merná tepelná kapacita | 0,855 J K−1 g−1 (kvapalina) 0,532 J K−1 g−1 (plyn) | ||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Ďalšie informácie | |||||||||||||||||||||||||||||||||||||
| Číslo CAS | 10026-04-7 | ||||||||||||||||||||||||||||||||||||
| Číslo UN | 1818 | ||||||||||||||||||||||||||||||||||||
| EINECS číslo | 233-054-0 | ||||||||||||||||||||||||||||||||||||
| Číslo RTECS | VW0525000 | ||||||||||||||||||||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||||||||||||||||||||||||
Chlorid kremičitý SiCl4 je jedným z halogenidov kremíka. Je to bezfarebná prchavá kvapalina.
Príprava
Chlorid kremičitý sa pripravuje chlórovaním niektorých zlúčenín kremíka, ako je napríklad ferosilícium, karbid kremíka alebo zmes oxidu kremičitého a uhlíka:
- SiC + 4 HCl → SiCl4 + CH4
Ferosilícium sa používa najčastejšie.[1]
Reakcia
Hydrolýza a podobné reakcie
Rovnako ako ostatné chloridy kremíka aj chlorid kremičitý reaguje s vodou:
- SiCl4 + 2 H2O → 4 HCl + SiO2
S metanolom a etanolom reaguje za vzniku tetrametyl a tetraetylortokremičitanu: SiCl4 + 4 ROH → Si(OR)4 + 4 HCl
Reakcia s ostatnými nukleofilmi
Chlorid kremičitý vytvára rad organokremičitých zlúčenín reakciami s Grignardovými činidlami [2] a organolítnymi zlúčeninami:
- 4 RLi + SiCl4 → R4Si + 4 LiCl
Redukciou hydridu vzniká silán.
Použitie
Veľmi čistý chlorid kremičitý sa používa na výrobu fotovoltaických článkov.
Podobné zlúčeniny
- Bromid kremičitý
- Fluorid kremičitý
- Jodid kremičitý
- Tetrachlórmetán
- Chlorid ciničitý
- Chlorid germaničitý
- Chlorid titaničitý
- Chlórsilán
- Dichlórsilán
- Trichlórsilán
Referencie
- ↑ Walter Simmler: "Silicon Compounds, Inorganic" in Ullmann 's Encyclopedia of Industrial Chemistry, 2000, Wiley-VCH, Weinheim. DOI:10.1002/14356007.a24_001
- ↑ Norman Neil Greenwood, Alan Earnshaw, Chemistry of the Elements, 2nd ed., Butterworth-Heinemann, Oxford, UK, 1997. ISBN 0-7506-3365-4
Literatúra
- VOHLÍDAL, Jiří; ŠTULÍK, Karel; JULÁK, Alois. Chemické a analytické tabuľky. 1. vyd. Praha : Grada Publishing, 1999. ISBN 80-7169-855-5.
Zdroj
Tento článok je čiastočný alebo úplný preklad článku Chlorid křemičitý na českej Wikipédii.
Text je dostupný za podmienok Creative Commons Attribution/Share-Alike License 3.0 Unported; prípadne za ďalších podmienok. Podrobnejšie informácie nájdete na stránke Podmienky použitia.
Antropológia
Aplikované vedy
Bibliometria
Dejiny vedy
Encyklopédie
Filozofia vedy
Forenzné vedy
Humanitné vedy
Knižničná veda
Kryogenika
Kryptológia
Kulturológia
Literárna veda
Medzidisciplinárne oblasti
Metódy kvantitatívnej analýzy
Metavedy
Metodika
Text je dostupný za podmienok Creative
Commons Attribution/Share-Alike License 3.0 Unported; prípadne za ďalších
podmienok.
Podrobnejšie informácie nájdete na stránke Podmienky
použitia.
www.astronomia.sk | www.biologia.sk | www.botanika.sk | www.dejiny.sk | www.economy.sk | www.elektrotechnika.sk | www.estetika.sk | www.farmakologia.sk | www.filozofia.sk | Fyzika | www.futurologia.sk | www.genetika.sk | www.chemia.sk | www.lingvistika.sk | www.politologia.sk | www.psychologia.sk | www.sexuologia.sk | www.sociologia.sk | www.veda.sk I www.zoologia.sk