
A | B | C | D | E | F | G | H | CH | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | X | Y | Z | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9
Archív
Obsah
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 | 31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 | 39 | 40 | 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | 49 | 50 | 51 | 52 | 53
1

Oxid uhoľnatý je bezfarebný plyn bez chuti a zápachu, je ľahší ako vzduch, nedráždivý. Vo vode je málo rozpustný. Je obsiahnutý vo svietiplyne, v generátorovom a vo vodnom plyne. Má silné redukčné vlastnosti, pri vysokej teplote odčerpáva kyslík viazaný v oxidoch kovov. V prírode je prítomný v nepatrnom množstve v atmosfére, kde vzniká predovšetkým fotolýzou oxidu uhličitého pôsobením ultrafialového žiarenia, ako produkt nedokonalého spaľovania fosílnych palív či biomasy. Je tiež obsiahnutý v sopečných plynoch. V medzihviezdnom priestore sa vyskytuje v značnom množstve. Našiel sa aj v atmosfére Marsu (0,08 %) a spektroskopiou bol preukázaný v kométach.
Oxid uhoľnatý je jed, ktorý zapríčinil pravdepodobne najviac otráv v histórii ľudstva.
Pripravuje sa spaľovaním uhlíka s malým množstvom kyslíka:
- 2 C + O2 → 2 CO,
prípadne reakciou vodných pár s uhlíkom pri vysokých teplotách (príprava vodného plynu):
- C + H2O → CO + H2.
V nepatrnom množstve vzniká aj metabolickými procesmi v živých organizmoch, a preto je obsiahnutý v stopových množstvách vo vydychovanom vzduchu z pľúc.
S kyslíkom sa prudko zlučuje (horí modrým plameňom) na oxid uhličitý:
- 2 CO + O2 → 2 CO2
za uvoľnenia značného množstva tepla. V zmesi so vzduchom, obsahujúci od 12,5 až 74,2 % oxidu uhoľnatého, vybuchuje.
Oxid uhoľnatý je značne jedovatý, jeho jedovatosť je spôsobená silnou afinitou k hemoglobínu, vytvára s ním karboxyhemoglobín, čím znemožnuje prenos kyslíka v podobe oxyhemoglobínu z pľúc do tkanív. Väzba oxidu uhoľnatého na hemoglobín je približne dvestokrát silnejšia ako s kyslíkom a preto jeho odstránenie z krvi trvá mnoho hodín až dní. Príznaky otravy sa objavujú už pri premene 10 % hemoglobínu na karboxyhemoglobín. Toto je jednou z príčin škodlivosti fajčenia. Na oxid uhoľnatý sú najcitlivejšie tehotné ženy a ich plody, ďalej malé deti, osoby s ochoreniami srdcovo-cievneho aparátu a staré osoby. Otrava oxidom uhoľnatým sa prejavuje najčastejšie bolesťami hlavy, závratmi, hučaním v ušiach, sčervenaním v tvári, bolesťami končatín, búšením srdca.
2

Ropa je hnedá až nazelenalá horľavá kvapalina tvorená zmesou uhľovodíkov, najmä alkánov. Pravdepodobne vznikla rozkladom zvyškov pravekých rastlín a živočíchov. Nachádza sa vo vrchných vrstvách zemskej kôry – najčastejšie v oblasti kontinentálnych šelfov. Je základnou surovinou petrochemického priemyslu. Náleziská ropy sú pod nepriepustnými vrstvami, v hĺbkach až 8 km pod zemským povrchom. Ropa pri ťažbe alebo vyviera pod tlakom - ťažba samotokom, alebo sa čerpá - mechanizovaná ťažba. Vyskytuje sa spoločne so zemným plynom a vodou. Názov ropa pochádza z poľštiny, v preklade znamená „hnis“, ide o pôvodné staré označenie miestnych soľných prameňov.
Hustota ropy sa podľa druhu pohybuje v rozmedzí 0,730 až 1 g/cm³. Pre meranie objemu ropy sa používa miera 1 barel = 42 amerických galónov = 35 britských galónov = 158,97 litrov. Množstvo ropy sa tiež niekedy udáva v tonách, jednej tone zodpovedá približne 7,33 barelov.
Vznik ropy vysvetľujú dve navzájom si odporujúce teórie – anorganická a organická. Anorganický pôvod ropy predpovedal Mendelejev. Podľa tejto teórie ropa vznikla pôsobením prehriatej pary na karbidy ťažkých kovov v časoch, keď sa vyskytovali blízko zemského povrchu. V prospech tejto teórie svedčí jednak laboratórna príprava pevných, kvapalných a plynných uhľovodíkov z karbidov uránu, lantánu aj céru, a jednak neustály únik metánu z vnútra Zeme v niektorých oblastiach.
Organická teória je uznávaná väčšinou vedcov, predpokladá, že ropa vznikla z prehistorických živočíšnych a rastlinných zvyškov, ktoré podľahli rozkladu. Tie sa vplyvom tepla a tlaku premenili najskôr na kerogén, potom na živicu a nakoniec na ropu a zemný plyn. Tie potom migrovali pozdĺž nerastných vrstiev, až boli zachytené v poréznych horninách, čím vznikli ich súčasné náleziská. V prospech tejto teórie svedčia zistenia, že mladšia ropa sa veľkou relatívnou molárnou hmotnosťou, zvýšeným obsahom kyslíka, síry a dusíka a veľkým obsahom asfaltu približuje pôvodnému organickému materiálu. Čím je ropa staršia, tým je ľahšia, obsahuje menej asfaltu a viac uhľovodíkov.
3
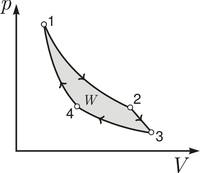
Tepelný stroj je zariadenie, ktoré pracuje na základe prvého termodynamického zákona, podľa ktorého je možné vzájomne premieňať teplo na vnútornú energiu alebo prácu. Tepelný stroj musí zároveň rešpektovať druhý termodynamický zákon, podľa ktorého nie je možné vykonávať premnu energií úplne. Tepelné stroje sa delia na:
- tepelné motory - v ktorých sa premieňa teplo dodávané so zásobníka s vyššou teplotou na prácu pri vzniku zostatkového tepla, ktoré je potrebné odviesť do zásobníka s nižšou teplotou. Pracovný cyklus takéhoto stroja v diagrame p-V prebieha v smere hodinových ručičiek.
- chladiace stroje alebo tepelné čerpadlá - v ktorých sa spotrebováva privedená mechanická práca na prenos tepla zo zásobníka s nižšou teplotou do zásobníka s vyššou teplotou. Pracovný cyklus takéhoto stroja v diagrame p-V prebieha proti smeru hodinových ručičiek.
Pracovný cyklus tepelného stroja (tepelný obeh) je séria postupných zmien stavu pracovnej látky ktoré začínajú a končia v rovnakom stave. Existuje viacero modelových pracovných cyklov tepelného stoja, špeciálne postavenie medzi nimi má Carnotov cyklus. Pre teoretické výpočty technických aplikácií sa používajú aj iné modely tepelných cyklov. V oblasti piestových spaľovacích motorov sa pracuje s:
V oblasti plynových turbín sa pracuje s:
4

Pušný prach je viaczložková výbušná zmes so širokým použitím v pyrotechnike na trhacie práce a výrobu zábavnej pyrotechniky, delobuchov alebo zápalníc. Bezdymový pušný prach nachádza využitie pri výrobe nábojov do strelných zbraní.
Čierny pušný prach je najstaršou známou výbušninou na svete. Vynašli ho v období siedmeho až deviateho storočia v Číne. Najskôr sa využíval na pohon rakiet, náplň granátov a dokonca aj bambusovej pušky. V 13. storočí prenikol pušný prach do Európy. Už v 14. storočí tu existovala prosperujúca výroba strelných zbraní. Vo veľkom ich začali používať v 15. storočí husiti. Husitská terminológia ranných strelných zbraní tak prenikla do mnohých svetových jazykov. Dnes je už takmer zabudnutý výraz arkebúza (ľahší variant muškety) vzniknutý presmyčkami z českej hákovnice. Stále je však živý výraz pištoľ (angl. pistol), ktorý vznikol z českého slova píšťala (najľahší variant ručných strelných zbraní), alebo anglické howitzer (nem. Haublitze) z pôvodnej českej húfnice. V roku 1887 si Alfred Nobel nechal patentovať bezdymový pušný prach pod názvom ballistit a jeho ďalším zdokonalením vznikol dnes najpoužívanejší kordit. Hlavnou zložkou je strelná bavlna kombinovaná s nitroglycerínom a inými nitroglykolmi. Tento nový prach sa vďaka svojím lepším vlastnostiam dnes používa v prakticky všetkých strelných zbraniach.
Typické zloženie čierneho pušného prachu je: 75 % KNO3, 10 % síry a 15 % dreveného uhlia. V praxi sa pušný prach vyrába alebo pre trhacie práce s nižším obsahom KNO3 v rozmedzí 60 - 70 % a pre vojenské využitie s obsahom KNO3 74 - 75 %.
5

História periodickej tabuľky. Chemické prvky poznali ľudia už v staroveku napríklad zlato, striebro alebo meď už z antickej doby, pretože sa dali ľahko objaviť v prírode a môhli byť vyťažené aj s primitívnymi nástrojmi. Do roku 1809 bolo objavených dohromady 47 prvkov. Ako počet prvkov rástol, vedci začali skúmať ich chemické vlatnosti a začali ich klasifikovať.
Lavoisierove dielo Traité Élémentaire de Chimie (Štúdia prvkov) je považované za prvú chemickú vedeckú prácu. Obsahovala zoznam prvkov a substacií ktoré sa nedali rozložiť, vrátane kyslíku, dusíku, fosforu, ortuti, zinku a síry. Tak isto sformuloval základný moderný zoznam prvkov. Tento model klasifikoval iba prvy na kovy a nekovy, čo nebolo akceptovateľné. Alexandre-Émile Béguyer de Chancourtois, francúzsky geológ, bol prvý vedec, ktorý upozornil na periodicitu prvkov - podobné prvky sa opakovali pokiaľ boli zoradené podľa ich atómových hmotností. Vymyslel rannú periodickú tabuľku, ktorú nazval telluric helix. Prvky dosadil do špirály podľa ich narastajúceho atómového čísla, de Chancourtois spozoroval, že prvky s podobnými vlastnostami boli pod sebou.
John Newlands bol anglický chemik, ktorý napísal dielo, ktoré v roku 1863 klasifikovalo 56 prvkov ktoré boli dovtedy objavené, klasifikoval ich do 11 skupín ktoré boli založené na podobných fyzikálnych vlastnostiach. Newlands zoskupil známe prvky do tabuľky podľa ich atómových hmotností. Zistil, že niekoľko opakujúcich zákonitosti. Tieto zákonitosti boli také, že keď zmenil zoznam prvkov na sedem skupín, prvý prvok každej skupiny zo skupiny bol podobný prvku z druhej, a tak isto to bolo aj s druhým prvkom v skupine a tak ďalej. Analogicky s tónovou stupnicov so siedmimy notami ktoré formovali oktávu, pomenoval svoj objav ako Law of Octaves.
Dmitrij Ivanovič Mendelejev bol prvý vedec ktorý vytvoril periodickú tabuľkú ktorá je veľmi podobná tej ktorú používame dnes. Mendelejev zoskupil prvky podľa ich atómových hmotností.
6

Fosgén je chemická zlúčenina s chemickým vzorcom COCl2. Za nízkych teplôt je to bezfarebná kvapalina, so zápachom po zatuchnutom sene alebo tlejúcom lístí. V plynnom stave je fosgén bezfarebný plyn, ktorý sa na vzduchu môže javiť ako biela až nažltlá hmla. V malých koncentráciách sa vyznačuje zápachom po čerstvo pokosenej tráve alebo zelenom obilí, vo vyšších koncentráciách je jeho zápach silný a nepríjemný. Plynný fosgén je vysoko toxická chemická látka, ktorá sa používala ako chemická zbraň počas Prvej svetovej vojny. V súčasnosti našiel fosgén svoje uplatnenie v priemysle. Malé množstvá fosgénu sa môžu vyskytovať aj v prírode pri rozklade chlórovaných organických zlúčenín, alebo aj pri spaľovaní niektorých chemikálii obsahujúcich chlór vo svojej molekule. Aj keď je fosgén oveľa menej nebezpečný než nervovoparalytické látky, je ešte stále považovaný za životaschopnú chemickú bojovú látku.
Ročne sa vyprodukuje okolo dvoch miliónov ton fosgénu na použitie v priemysle a pri výrobe rozličných chemických zlúčenín (polyuretánu, pesticídov, farbív, atď.). Z bezpečnostných dôvodov sa takmer vždy spotrebúva v tom chemickom závode, kde sa vyprodukoval. Priemyselne sa fosgén vyrába preháňaním čisteného oxidu uhoľnatého a chlóru cez ložisko s vysoko pórovitým (aktívnym) uhlím, ktoré pôsobí ako katalyzátor. Zjednodušene sa tento dej dá zapísať chemickou rovnicou:
- CO + Cl2 → COCl2
7

Kremík je chemický prvok v Periodickej tabuľke prvkov, ktorý má značku Si a protónové číslo 14. Je to pomerne tvrdý polokov s vysokou afinitou ku kyslíku. Elementárny kremík je na vzduchu neobmedzene stály, v okolitej prírode sa s ním však stretávame prakticky iba vo forme zlúčenín v ktorých sa vyskytuje iba s mocnosťou Si+4, s výnimkou obmedzených nálezov mikrokryštálov čistého kremíka prevažne v sopečných oblastiach (typová lokalita Nuevo Potosí na Kube). Je odolný voči väčšine anorganických kyselín s výnimkou zmesi kyseliny fluorovodíkovej (HF) a kyseliny dusičnej (HNO3), veľmi ľahko sa však rozpúšťa v alkalických roztokoch za vzniku kremičitanového aniónu SiO4-4.
Kremík (po lat. silex, silicis) prvýkrát identifikoval Antoine Lavoisier v roku 1787, a neskôr ho Humphry Davy (1800) omylom považoval za zlúčeninu. V roku 1811 Gay Lussac a Thénard pravdepodobne pripravili amorfný a nečistý kremík redukciou fluoridu kremičitého draslíkom. V roku 1824 Berzelius pripravil amorfný kremík pomocou približne rovnakej metódy ako Lussac. Berzelius tiež kremík vyčistil opakovaným premývaním. V súčasnosti je kremík (ang. silicon) je dôležitý prvok pre polovodiče a elektronické zariadenia, je región v Kalifornii, kde sú sústredené spoločnosti zaoberajúce sa vývojom takýchto zariadení, Silicon Valley (Kremíkové údolie), pomenovaný podľa tohto prvku.
8

Chlór je toxický svetlozelený plyn, patriaci medzi halogénov. Je pomenovaný podľa žltozelenej farby svojich pár (grécky žltozelený – chlóros). Je to veľmi reaktívny plyn, ktorý sa ochotne zlučuje s väčšinou prvkov periodickej tabuľky. Bol objavený v roku 1774 Carlom Wilhelmom Scheelom, ale súčasné pomenovanie mu dal až v roku 1810 anglický chemik sir Humphry Davy.
Chlór sa vyrába elektrolýzou roztaveného chloridu sodného. Voľný chlór je prudký jed. Pôsobí v styku s vodou, prítomnej v bunkách, oxidačne na životne dôležité molekuly (proteíny - enzýmy, lipidy aj sacharidy). Mení ich štruktúru a organizmus hynie. V potravinárstve sa označuje E925. V prvej svetovej vojne použili Nemci chlór a jeho ďalšie zlúčeniny (napr. fosgén COCl2 a yperit – dichlórdietylsulfid, bis-(2-chlóretyl-)sulfid) ako chemickú zbraň hromadného ničenia.
Na Zemi sa chlór nachádza iba vo forme zlúčenín, väčšina z nich je rozpustená v morskej vode a vo vode niektorých vnútrozemských jazier. V morskej vode tvoria chloridové ióny najviac zastúpený anión, ich koncentrácia sa pohybuje okolo 19 g/l. Z minerálov je najznámejší chlorid sodný (NaCl, mineralogicky kamenná soľ). Morská voda obsahuje 2,7 % chloridu sodného. Kaspické a Mŕtve more obsahujú až 10 % NaCl. Odparením pravekých morí vznikli ložiská kamennej soli. Najväčšie ložiská sú v Poľsku pri Bochni a Veličke, v Rumunsku pri Slaníku, v Rakúsku v Soľnej komore pri Salzburgu, v Rusku pri Astrachanských jazerách. Na Slovensku sú ložiská kamennej soli v Solivare pri Prešove, kde sa odparovaním soľanky získava kryštalická kuchynská soľ.
9

Atóm (grec. άτομον - nedeliteľný) je najmenšia, chemicky ďalej nedeliteľná častica chemického prvku, ktorá je nositeľom jeho vlastností. Tento pojem atómu zaviedli grécki filozofi Leukippos a Demokritos, všeobecne sa ujal až na začiatku 19. storočia. Ernest Rutherford a Niels Bohr objavili subatomárne častice a tým sa dokázalo, že atóm nie je nedeliteľný.
Atómy sa ďalej zlučujú do molekúl. V prirodzenom prostredí majú rovnaký počet elektrónov aj protónov, v tomto stave je atóm elektroneutrálny. Ak sa tento pomer zmení, vzniká ión, ktorý je buď kladný (katión) alebo záporný (anión). Molekula, atóm či dokonca jeho subatomárne častice sú v neustálom pohybe.
10

Galvanický článok je chemický zdroj elektrického napätia, ktorý sa skladá z dvoch materiálov spojených elektrolytom. Je tiež známy ako elektrochemický článok, a v jeho praktickom prevedení ako monočlánok.
Galvanický článok dostal svoj názov podľa talianskeho lekára a prírodovedca Luigiho Galvaniho, ktorý v roku 1780 pri pitvaní žabích stehienok spozoroval ich zášklby po dotyku dvoch rozdielnych kovových predmetov na rôzne konce nervov, podobné zášklbom vyvolávaným elektrickým nábojom. Tento jav správne vysvetlil taliansky fyzik Alessandro Volta, a to vznikom elektrického napätia medzi dvoma kovmi (nástrojom a kovovým podkladom) vodivo prepojenými elektrolytom (obsiahnutých v bunkách). Na základe týchto úvah zostavil v roku 1800 článok, skladajúci sa z medenej a zinkovej elektródy ponorenej do roztoku kyseliny sírovej. Voltov článok dával napätie približne 1 V a stal sa prvým zdrojom stáleho elektrického prúdu, do tej doby sa elektrina vytvárala trením alebo indukčnou elektrinou. Objav Voltovho článku vydláždil cestu pre rozvoj skúmania elektrických javov.
Galvanické články sa používajú predovšetkým v prenosných elektrických spotrebičoch - baterkách, hodinkách, mobilných telefónoch, prenosných počítačoch, fotoaparátoch, kamerách, všade tam, kde sa spotrebič nedá pripojiť na elektrickú sieť alebo priamo použiť mechanický zdroj generátora. Výhodou galvanických článkov môže byť nízke elektromotorické napätie, nízky výkon a krátka životnosť. Akumulátory sa dajú použiť aj na uloženie elektrickej energie, sú potrebné pri prerušení dodávky zo siete, napríklad v záložných zdrojoch alebo ako zdroj elektriny v stojacom automobile.
11

Kyslosť alebo acidita alebo pH (z lat. potencia hydrogeni) alebo vodíkový exponent je číslo, ktorým vyjadrujeme v chémii či vodný roztok reaguje kyslo alebo zásadito. Koncept merania pH uviedol v roku 1909 Søren Peder Lauritz Sørensen. pH vodných roztokov získava hodnoty od 0 do 14. Chemicky čistá voda má pH = 7, kyseliny od 0 do 6, hydroxidy od 8 do 14.
Hodnota pH je definovaná ako záporný dekadický logaritmus aktivity oxóniových katiónov. V zriedených vodných roztokoch sa dá hodnota aktivity aproximovať hodnotou látkovej koncentrácie a potom platí:
- — relatívna koncentrácia vodíkových katiónov (bezrozmerné)
alebo tiež
- ,
kde () je elektromotorická sila (EMF) alebo napätie galvanického článku.
Vo vodnom roztoku je vždy okrem molekúl H2O tiež určité množstvo oxóniových katiónov H3O+ a hydroxylových aniónov OH-. Súčin koncentrácií oboch týchto iónov je vo vodných roztokoch vždy konštantný. Je označovaný ako iónový súčin vody a získava hodnoty 10-14. V čistej vode je látková koncentrácia oboch iónov rovnaká: 10-7. To zodpovedá pH = 7. Kyslosť vzniká prebytkom katiónov H3O+. Zvýšením ich koncentrácie na stonásobok, čiže 10-5, zodpovedá pH = 5. Zásaditosť je prebytok hydroxylových iónov na úkor oxóniových. Ak je v roztoku mapríklad 1000× viac OH- ako vo vode, klesne koncentrácia iónov H3O+ na 10-10, čo zodpovedá pH = 10.
Pre hrubú orientáciu o kyslosti meraného roztoku sa na meranie pH používa lakmusový papierik, čo je prúžok papierika napusteného lakmusom. Presnejší údaj o kyslosti meraného roztoku poskytuje univerzálny indikátorový papierik ktorého zafarbenie sa mení s pH meraného roztoku od červenej až po tmavo modrú (farebnú škálu vystihuje vedľajšia tabuľka hodnôt pH bežne sa vyskytujúcich roztokov).
Kyslosť nevodných roztokov (napríklad roztoky kyselín alebo hydroxidov v alkoholoch, ketónoch alebo aj v nepolárnych rozpúšťadlách) popisuje hodnota Hammetovej funkcie. Veľkosť Hammetovej funkcie pre určité prostredie sa prakticky zisťuje na základe pomerov kyslej a zásaditej formy určitého acidobazického indikátoru v mernom roztoku.

Plynová chromatografia (angl. gas chromatography – GC) je chromatografická metóda, pri ktorej je mobilnou fázou plyn. Je vhodná na separáciu plynných a nízkovriacich kvapalných zmesí.
Medzi hlavné časti moderného plynového chromatografu patrí injektor, regulátor prietoku, zásobník nosného plynu (hélium, vodík, dusík, zriedkavejšie argón), termostat, kolóna (náplňové a kapilárne kolóny), detektor, vyhodnocovacie zariadenie
Použité sú tri náplňové kolóny. Kolóny sa väčšinou zhotovujú zo skla, plastu resp. nerezovej ocele. Náplňou býva silikagél, kremelina, oxid hlinitý, molekulové sito atď. Podmienkou toho, aby sme mohli zmes rozdeliť pomocou plynovej chromatografie je, že zmes musí byť plynná resp. ľahko odpariteľná (kvapalina musí mať teplotu varu max. 200—250 °C).
Vzorka sa privádza do injektora pomocou tvz. Hamiltonovej ihly (pri kvapalných vzorkách) alebo pomocou plynovej vzorkovnice (sklenej resp. kovovej — v závislosti od tlaku). V injektore, ktorý je temperovaný, prebieha zohriatie prípadne odparenie vzorky a tá je postupne unášaná prúdom nosného plynu do kolóny. V kolóne dochádza ku samotnej separácii zložiek zmesi podľa toho, akú afinitu vykazujú tieto zložky k povrchu resp. náplni kolóny.
Prvá vychádza z kolóny zložka, ktorá má ku nej najnižšiu afinitu (zároveň má najvyššiu afinitu ku nosnému plynu). Ako posledná vychádza zložka, ktorá má k povrchu kolóny najvyššiu afinitu (má teda najnižšiu afinitu ku nosnému plynu). Výstup už rozdelených zložiek zmesi z kolóny zaznamenáva chromatografický detektor. Z detektora vychádza elektrický signál, ktorý do žiadanej podoby spracúva vyhodnocovacie zariadenie. Výstupom vyhodnocovacieho zariadenia je graf obsahujúci tzv. špičky (po angl. peaks).
Detektor tvorí dôležitú súčasť každého plynového chromatografu. Jeho úlohou je detekovať už rozdelené zložky zmesi, ktoré opúšťajú kolónu. Vo všeobecnosti sa dá povedať, že detektor premieňa analytický signál (elúciu zložky) na elektrický signál (v podobe elektrického prúdu alebo elektrického napätia). Existuje viacero typov a voľba správneho detektoru záleží na povahe zložiek separovanej zmesi.
Poloha špičky na časovej osi je mierou kvality zložky (identifikuje zložku) a plocha špičky je mierou kvantity zložky v separovanej zmesi.

Kyanid draselný alebo cyankáli je draselná soľ kyseliny kyanovodíkovej. Chemický vzorec je KCN. Je to biela kryštalická látka, reagujúca silno alkalicky, napríklad reakciou so vzdušným oxidom uhličitým postupne prechádza na uhličitan draselný (potaš) za vzniku kyanovodíka. Je silno hydroskopická a pohlcuje vzdušnú vlhkosť.
- KCN(s) + CO2(g) + H2O(g) → K2CO3(s) + 2 HCN(g)
Technická výroba kyanidu draselného spočíva v neutralizácii hydroxidu draselného kyanovodíkom a v následnom odparovaní.
- HCN + KOH → KCN + H2O
V minulosti sa cyankáli vyrábalo z oxidu uhoľnatého, amoniaku a z uhličitanu draselného pri teplote 600 °C.
Kyanid draselný je silný jed (akútna toxicita LD50 je odhadovaná na 2 - 3,3 mg/kg telesnej hmotnosti perorálne, teda asi 150 - 250 mg KCN per os pre osobu telesnej hmotnosti 75 kg), ktorý blokuje primárne (ako aj kyanovodík a iné ionizované kyanidy; vlastným jedom je kyanidový anión, CN-) bunkové dýchanie ireverzibilnou blokádou cytochrómoxidázy c (aa3), jedného z kľúčových enzýmov bunkového dýchania na mitochodriálnej membráne; kyanidové anióny vytvárajú veľmi stabilný komplex s oxidovanou formou cytochrómoxidázy c, konkrétne s jej centrálnym železitým katiónom, Fe3+:
- FeIII+Ln + 6 CN- → FeIII+(CN)63- + n L
Touto reakciou sa cytochrómoxidáza c blokuje a znemožňuje sa ďalšie využitie kyslíka a elektrónový transport na mitochondriálnej membráne. Toto vedie k veľmi rýchlo nastupujúcej bunkovej hypoxii. Najrýchlejšie postihnuté sú tkanivá s vysokou spotrebou kyslíka, t.j. hlavne mozgové tkanivo a myokard, čo má za následok pri dostatočnej dávke rýchlu smrť v dôsledku paralýzy vitálnych centier v CNS a následne i srdečného svalu. V dôsledku potlačenia aeróbnych procesov dochádza k prevahe anaeróbnych procesov, čo má za následok metabolickú (laktátovú) acidózu.

Alchýmia (z arab. al-chimija = umenie zlievania) je protovedecká a filozofická disciplína, ktorá kombinuje prvky chémie, metalurgie, fyziky, medicíny, astrológie, sémiotiky, mystiky a umenia. Alchýmia bola praktizovaná v starovekom Egypte, Indii, Číne, starovekom Grécku, Ríme, islamskej ríši a nakoniec v Európe do konca 19. storočia v sieti škôl a filozofických systémov starých aspoň 2500 rokov. Vychádza z náuky o príbuznosti a premenách látok a zameriava sa na proces zdokononaľovania prírody, skúma prirodzenosť tiel a ich meniacu sa silu.
Snahy alchymistov sa označujú ako Veľké dielo (Opus Magnum). Predstava rastu poukazuje na fakt, že človek nemôže urobiť strom, ale môže sa podieľať na jeho pestovaní (v prenesenom slova zmysle, podieľať sa na Diele Božom). Alchymisti nepoužívali vedeckú metódu. Všetky ich „poznatky“ neskôr materialistická veda označila za banálne, obmedzené, nesprávne alebo aspoň nezmyselné. Napriek tomu bola alchýmia jedna z hlavných predchodcov moderných vied a starým alchymistom vďačíme za objavenie mnohých látok a procesov, ktoré sú dnes dôležité pre modernú chémiu a kovospracujúci priemysel. Dnes je alchýmia zaujímavá hlavne pre historikov vedy a filozofie, pre svoj mystický, ezoterický a umelecký aspekt.
Slovo alchýmia pochádza z arabského jazyka al-kímijá alebo al-chímijá الكيمياء alebo الخيمياء), ktoré je pravdepodobne vytvorené z predpony al- a gréckeho slova chumeia (χυμεία) znamenajúce „zlievať spolu“, „zvárať“, „spájať“ (z khumatos „ten ktorý je poliaty“). Podľa predpisu Diokleciána, napísaného asi v roku 300 po Kr. v Grécku, proti „starovekým dielam Egypťanov, ktoré vyjadrovali khēmia ako transmutáciu zlata a striebra“.
Prepokladalo sa, že arabské slovo al-kímijá vlastne znamená „egypskú vedu“, vypožičaním koptského slova pre „Egypt“ kēme (alebo jeho ekvivalentu v starovekom Bohairickom dialekte koptčiny, khēme). Koptské slovo bolo vytvorené z démotického kmỉ, zo starého egyptského jazyka kmt. Staroveké egyptské slovo uvádza obe krajiny a farbu „čierna“ (egypt bola čierna krajina, pri kontraste ku „červeným krajinám“ púštnych oblastí), preto tento etymologický význam môže taktiež vyjadrovať označenie „egyptskej čiernej mágie“. Napriek tomu je táto teória iba príklad ľudovej etymológie.

Hélium (gr. ήλιος (hélios) = Slnko) je chemický prvok v Periodickej tabuľke prvkov, ktorý má značku He a protónové číslo 2. Bezfarebný plyn, bez chuti a zápachu, chemicky úplne inertný - nie sú známe žiadne chemické zlúčeniny hélia. V potravinárstve sa označuje ako E939.
Hélium sa na Zemi vyskytuje iba veľmi vzácne. V zemskej atmosfére sa vyskytuje iba vo vyšších vrstvách a vďaka svojej mimoriadne nízkej hmotnosti postupne z atmosféry vyprcháva do medziplanetárneho priestoru. V menšom množstve sa nachádza v zemnom plyne, z ktorého sa získava vymrazovaním. Hélium aj zriedkavo vyviera z trhlín v zemi, najznámejšie oblasti týchto prameňov ležia v Skalistých horách v USA. Predpokladá sa, že toto hélium je produktom jadrového rozpadu prvkov v zemskej kôre.
Vo vesmíre je hélium po vodíku druhým najviac zastúpeným prvkom. Vyskytuje sa predovšetkým vo všetkých svietiacich hviezdach, kde je jedným z medzistupňov termonukleárnej syntézy, ktorá je podľa súčasných teórií základným energetickým zdrojom vo vesmíre. Tvorí približne 25 % hmoty okolitého pozorovateľného vesmíru. Samotný objav hélia prišiel so skúmaním spektra slnečnej korony, keď v roku 1868 francúzsky astronóm Pierre Janssen objavil neznáme spektrálne čiary, ktoré boli pripísané doposiaľ neznámemu prvku, pomenovanému po starogréckom bohovi Slnka, Héliovi. Až v roku 1895 sa britskému chemikovi Williamovi Ramsayovi podarilo izolovať plynné hélium na Zemi.
Vzhľadom na svoju extrémne nízku hustotu a inertné správanie sa hélium používa na plnenie balónov a vzducholodí ako náhrada horľavého vodíka. Značnou nevýhodou je jeho pomerne vysoká cena. Navyše má atóm hélia veľmi malý priemer, ľahko difunduje aj cez pevné materiály a dochádza tak ku stratám. Zmesou hélia, kyslíka a dusíka (Trimix) sa plnia tlakové fľaše určené na potápanie do veľkých hĺbok. Na rozdiel od dusíka totiž hélium nemá pri zvýšenom tlaku narkotické účinky a zmenšuje sa tak riziko vzniku dusíkového opojenia vo väčších hĺbkach. Hélium sa tiež používa ako nosný plyn pre kapilárnu plynovú chromatografiu s hmotovo spektrometrickou detekciou.
Mimoriadne nízka teplota varu predurčuje kvapalné hélium, ako jedno zo základných médií pre kryogénne techniky, predovšetkým na výskum a praktické využitie supravodivosti rôznych materiálov.

Uhlie je čierna alebo hnedočierna (tzv. hnedé uhlie — lignit) horľavá hornina. Získava sa z povrchových alebo hlbinných dolov a používa sa predovšetkým ako palivo. Od dôb priemyselnej revolúcie je uhlie veľmi dôležitou energetickou surovinou. Väčšina svetovej výroby elektrickej energie sa uskutočňuje práve v uhoľných (t.j. tepelných) elektrárniach. Uhlie je zložené predovšetkým z uhlíka, obsahuje však rozmanité zložky vrátane sírnych zlúčenín. Uhlie je celosvetovo najdôležitejší zdroj pre výrobu elektrickej energie (približne 40 %). Uhlie vzniklo z rastlinných a živočíšnych zvyškov, ktoré boli uložené v anaeróbnom vodnom prostredí, kde nízky obsah kyslíka zabraňoval ich úplnému rozkladu a oxidácii (t.j. hnitiu).
- lignit — tiež označovaný ako hnedé uhlie je najmenej kvalitný druh uhlia. Používa sa len na parnú výrobu elektrickej energie. Leštený lignit sa od doby železnej používal ako ozdobný kameň.
- hnedo-čierne — jeho vlastnosti sú kombináciou vlastností čierneho a hnedého uhlia, použitie má rovnaké ako lignit
- čierne uhlie — je charakteristické vysokou hustotou, jeho farba je obvykle hnedočierna až čierna
- antracit — najkvalitnejšie uhlie, používa sa na vykurovanie
Uhlie je najčastejšie používané tuhé palivo na výrobu tepla spaľovaním. Svetová spotreba uhlia je 5 200 miliónov ton ročne, z toho je 75 % využívaných na výrobu elektrickej energie. V oblasti Číny a Indie sa ročne spotrebuje 1 500 miliónov ton uhlia a predpokladá sa, že v roku 2025 narastie táto spotreba na 2 700 miliónov ton ročne. V USA sa každoročne spotrebuje miliarda ton uhlia, z toho až 90 % na výrobu elektrickej energie. Pri výrobe elektrickej energie sa spaľuje uhlie rozomleté na prach v špeciálnom horáku, ohrieva vodu na vodnú paru, ktorá roztáča turbíny a generátory. Pri udržaní súčasnej spotreby vystačia zásoby uhlia na približne 300 rokov.

Voda (chemický vzorec H2O) je chemická zlúčenina vodíka a kyslíka. Je základnou podmienkou pre existenciu života na Zemi. Za normálnej teploty a tlaku je to bezfarebná, číra kvapalina bez zápachu a chuti. V prírode sa vyskytuje v troch skupenstvách: v pevnom (sneh, ľad), v kvapalnom (voda) a v plynnom (vodná para). Je najrozšírenejšou látkou na Zemi. Je podstatnou zložkou biosféry a má popri pôde prvoradý význam pre zabezpečenie výživy ľudstva.
- Je základnou zložkou biomasy, hlavným prostriedkom pre transport živín, pre ich prijímanie a vylučovanie.
- Pre rastliny je významné nielen jej celkové množstvo za rok, ale tiež výskyt a rozdelenie vo vegetačnom období vzhľadom na ich rastové fázy.
- Pre mnohé živočíchy je voda priamo životným prostredím.
Voda predstavuje chemickú zlúčeninu dvoch atómov vodíka (H) a jedného atómu kyslíka (0). Atómy v molekule vody sú viazané jednoduchou polárnou kovalentnou väzbou. Intermolekulové vodíkové mostíky sú príčinou napr. vysokej teploty varu vody 100 °C. V prírode sa vyskytuje v plynnom, kvapalnom a v tuhom skupenstve. Pre svoj dipólový charakter je voda dobrým rozpúšťadlom iónových zlúčenín.
Zem prijíma žiarenie zo Slnka, zemský povrch sa zahrieva, voda sa premieňa na paru, ktorá vystupuje do atmosféry. V chladnejšom prostredí atmosféry sa vodné pary kondenzujú, tvoria oblaky, v kvapalnej alebo tuhej forme padajú na zemský povrch a začnú ihneď stekať po ňom alebo do neho vnikať. Časť spadnutých zrážok sa vyparí a pokračuje naďalej v obehu.
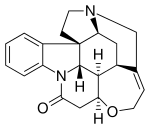
Strychnín je zložitý, bezfarebný steroidný alkaloid vyskytujúcí sa v semenách rastliny strychnínovník indický (Strychnos nux-vomica L.). V semenách se taktiež nachádza obdobný alkaloid brucín, ktorý má podobné, ale slabšie účinky. Obe látky majú výraznu horkú chuť, patria medzi najviac horké látky vôbec; chuťovo ich človek odhalí pri koncentráci okolo 1 ppm (0,0001 %). V čistom stave je strychnín biela kryštalická látka, málo rozpustná vo vode.
Strychnín je typický kŕčový jed. Ako inhibítor glycínového receptoru blokuje retardéry synaptického prenosu zadných koreňov miechy a umožnuje rozsiahle rozšírenie podráždenia. Malé dávky zvyšujú miechové reflexy, vyššie dávky už dráždia centrum v predĺženej mieche. Sebamenšie impulzy vedú k rychlým a nezastaviteľne sa rozširujúcim záchvatom nekoordinovaných reflexných kŕčov. Veľké dávky spôsobujú ochrnutie centrálnych nervov. Protijedom strychnínu sú barbituráty, tradičné lieky na spanie, a naopak - strychnín sa používa ako protijed pri otravách barbiturátmi (ktoré sú častejšie ako otravy strychnínom). Strychnín sa veľmi ľahko vstrebáva z podkožia a z tráviaceho traktu. Asi pätina jedu sa vylučuje močom nezmenená, pričom toto vylučovanie začne takmer ihneď po použití, ale pretrváva ešte niekoľko dní. Štyri pätiny jedu sa odbúrajú v pečeni. Strychnín sa dá v mŕtvom tele preukázať ešte mnoho mesiacov po smrti.
Otrava strychnínom má dve štádia. Pri prvom dôjde ku zbystreniu zraku, sluchu, hmatu a čuchu, ktoré vyvrcholí natoľko, že je to až nepríjemné. Vnímanie bolesti sa znižuje. Otrávený býva ľahko podráždený. Vyskytujú sa nezvyklé pocity stuhlosti v žuvacích svaloch. Prehĺtanie sa stáva ťažším, niekedy sa prejavuje závrat. Tieto príznaky sa môžu prejaviť i ako vedľajšie účinky pri liečbe strychnínom. Toto štádium trvá rôzne dlho, závisí na veľkosti dávky a spôsobu podania, ide väčšinou o štvrť až pol hodinu. Potom dochádza ku stupňovaniu úzkosti do stavu, označovaného ako smrteľná úzkosť. Každý silnejší vnem je nepríjemný, otrávený sa zľakne aj maličkostí. Najviac postihnuté sú sluchové vnemy, ale dráždia ho i vnemy zrakové a hmatové. V tomto štádiu sa objavuje aj triaška.

Glukóza alebo hroznový cukor (D-glukóza aj dextróza alebo škrobový cukor) je monosacharid patriaci medzi aldohexózy. V chemických vzorcoch oligosacharidov a polysacharidov sa značí symbolom Glc. V čistom stave je glukóza biela kryštalická látka so sladkou chuťou. D-glukóza sa môže pripraviť kryštalizáciou z rastlinných štiav, najmä z hrozien vinnej révy, ale hlavnou metódou jej výroby je kyslá alebo enzymatická hydrolýza rastlinného škrobu, na Slovensku predovšetkým zemiakového.
Glukóza existuje v dvoch enantioméroch a to ako D-glukóza (vyskytujúca sa v prírode), nazývaná aj dextróza a jej zrkadlový obraz, L-glukóza. Tie sa svojimi chemickými a fyzikálnymi vlastnosťami nelíšia, s výnimkou toho, že ich vodný roztok otáča rovinu polarizovaného svetla opačným smerom. V živých organizmoch sú však nezameniteľné.
Vzhľadom na prítomnosť aldehydickej skupiny patrí glukóza k redukujícím sacharidom, čiže napr. redukuje soli dvojmocnej medi na jednomocné, čo sa v minulosti používalo na kvalitatívne aj kvantitatívne stanovenie cukru v roztoku (napr. v moči). Pritom sa aldehydická skupina D-glukózy mení na karoboxylovú a vzniká kyselina D-glukonová. Pri použití silnejších oxidačných činidiel, ako napr. kyseliny dusičnej, sa oxiduje aj primárna alkoholická skupina na opačnom konci molekuly tiež na karboxylovú skupinu za vzniku kyseliny D-glukarovej. Ak sa zoxiduje len primárna alkoholická skupina na poslednom uhlíku (s lokačným číslom 6), vzniká kyselina D-glukurónová.
Redukciou glukózy napr. hydrogenáciou vodíkom za prítomnosti katalyzátorov sa naopak redukuje aldehydická skupina na primárnu alkoholickú skupinu a vzniká D-glucitol, známejší pod názvom sorbitol (sorbit), používaný ako umelé sladidlo pre diabetikov.
V roztoku prechádza glukóza do cyklickej hemiacetalovej formy so šesťčlenným kruhom (pyranosa), ktorá v rovnovážnom stave za laboratórnej teploty 20 °C obsahuje dva anoméry, lišiace sa orientáciou hemiacetalového hydroxylu: 36 % α-glukopyranózy a 64 % β-glukopyranózy.

Eutektikum (z gréc. dobre taviteľný) je zmes dvoch alebo viacerých fáz navzájom v sebe úplne nerozpustných, alebo len čiastočne rozpustných (t.j. majú heterogénnu oblasť), ktorá má menšiu teplotu tavenia ako každá z týchto látok. V tekutom stave musia byť navzájom rozpustné (ak nie, tak je to monotektický systém).
Eutektikum zliatiny konkrétnych látok má nasledovné vlastnosti:
- má vždy presné percentuálne zloženie daných zložiek
- roztavenie eutektika na taveninu a jeho spätné stuhnutie (fázové premeny) prebieha pri konštantnej teplote a bez medzifázy
Na obrázku máme príklad eutektika, na osi x máme pomer roztoku, na osi y teplotu. V bode eutectique pur máme najnižšiu možnú teplotu tuhnutia týchto látok. V tomto bode sa látka prejde do tekutého stavu hneď a bez medzifázy, mimo tento bod existuje vedla tekutej fázy aj pevná fáza (niečo ako cesto). Fázový diagram zliatin s eutektikom je typická V-charakteristika na prechode medzi taveninou a tuhým skupenstvom. Obrázok je pre systémy, kde v tuhom skupenstve sú obidve látky navzájom nerozpustné. Oblasť označená (4) je oblasť nerozpustnosti (heterogénna oblasť), kde sú tieto látky navzájom nerozpustné a teda tvoria heterogénnu zmes.
Ak sú čiastočne rozpustné, potom pribudne ešte zvislé V zľava (oblasť alfa) a zprava (oblasť beta). Alfa znamená, že máme kryštál s dominantnou alfou a s plne rozpustenými minoritnými beta atómami. Pri opustení alfa oblasti (buď znižovaním teploty alebo pridávaním komponenty beta) sa na rozhraní kryštálov vylučuje malé množstvo kryštálov s dominantnou betou, teda takých, ktoré sú obyčajne v oblasti beta vpravo. Toto funguje aj obrátene zo smeru z beta oblasti. Keď zvyšujeme podiel beta, tak sa vylučuje stále viac beta kryštálov až v eutektickom bode (5) sa vytvoria vedľa seba typické eutektické dlhé kryštálové lamely alfy prekladané s dlhými beta-kryštálovými lamelami.

Uhlík (lat. Carboneum) je chemický prvok v Periodickej tabuľke prvkov, ktorý má značku C a protónové číslo 6. Uhlík je typický nekovový prvok, ktorý sa ako nerast v elementárnom stave vyskytuje v prírode v dvoch základných modifikáciách a v posledných približne 20 rokoch bola laboratórne vytvorená tretia modifikácia:
- Grafit je tvorený uhlíkom, ktorý kryštalizuje v šesťuholníkových šupinkách a patrí medzi najmäkkšie známe nerasty. Táto vlastnosť sa využíva napr. pri výrobe ceruziek, v ktorých mletá tuha tvorí základnú zložku tyčinky určenej na písanie a kreslenie.
- Diamant je tvorený uhlíkom, ktorý kryštalizuje v kockovej sústave a je najtvrdším a veľmi cenným prírodným nerastom. Váha diamantov sa udáva v karátoch, najväčším doposiaľ nájdeným diamantom bol Cullinan, ktorý v surovom stave pri nájdení v JAR mal hmotnosť 3 106 karátov.
- Fullerény sú novo objavené sférické molekuly, zložené z päť alebo častejšie so šesťčlenných kruhov atómov uhlíka. V priestore sú tieto molekuly usporiadané do guľovitého tvaru a sú mimoriadne odolné voči vonkajším fyzikálnym vplyvom. Zatiaľ najstabilnejší známy fullerén je molekula, obsahujúca 60 uhlíkových atómov. Fullerény sa umelo pripravujú pyrolýzou organických zlúčenín laserom. Za objav a štúdium vlastností fullerénov bola v roku 1996 udelená Nobelova cena za chémiu Robertovi F. Curlovi, Richardovi E. Smalleyovi a Haroldovi W. Krotoovi. V súčasnosti je výskum vlastností a metód prípravy fullerénov veľmi intenzívne skúmaný v mnohých špičkových vedeckých inštitúciách po celom svete.

Prvá termodynamická veta alebo prvý termodynamický zákon je vo fyzike nasledujúci zákon:
Znenie:
- formulácia 1: Každá fyzikálna sústava má stavovú veličinu nazývanú vnútorná energia (U), ktorá sa mení len prostredníctvom výmeny energie s okolím (objemová práca, tepelná výmena)
- formulácia 2: ΔU = ΔQ - Δ(Wp + Wk) , kde:
- ΔU: zmena vnútornej energie sústavy
- ΔQ: zmena tepla sústavy (+ znamená dodanie, - znamená odobratie)
- Δ(Wp + Wk): vykonaná/spotrebovaná objemová práca (+ znamená, že ju sústava vykonala, - znamená, že ju sústava spotrebovala)
- formulácia 3: Nie je možné skonštruovať perpetuum mobile prvého druhu (teda stroj, ktorý vyrába energiu z ničoho)
Prvý zákon termodynamiky môžeme aplikovať na deje prebiehajúce v uzavretých sústavách. Konvencia: Objemovú prácu budeme označovať súhrnne, nie ako rozdiel spotrebovanej a vykonanej. O tom, o akú prácu ide rozhoduje jej znamienko:
- — práca bola sústavou spotrebovaná (resp. jej bola dodaná)
- — prácu vykonala sústava
Koncentrácia je miera množstva látky v zmesi, najčastejšie v roztoku. Označuje sa rôzne podľa toho, ako koncentráciu vyjadrujeme. V symbolickom zápise sa niekedy koncentrácia látky A označuje ako , , .
Jednotkami SI sa koncentrácia dá vyjadriť rôznymi spôsobmi:
- Látková koncentrácia
Štandardným vyjadrením koncentrácie je použitie látkového množstva, kde koncentrácia je vyjadrená množstvom zložky na jednotku objemu mol.l−1. Pre látkovú koncentráciu zložky A platí:
- Hmotnostná koncentrácia
Pri roztokoch sa často stretneme s prepočtom látkového množstva na hmotnosť látky. To zjednodušuje prípravu roztokov, pretože stačí dané množtvo látky odvážiť. Koncentrácia je vyjadrená hmotnosťou zložky na jednotku objemu g.l−1. Pre hmotnostnú koncentráciu zložky A platí:
- Hmotnostný zlomok
Vyjadruje podiel hmotnosti zložky na jednotku hmotnosti zmesi. Môže sa vyjadriť aj v percentách (výsledok vynásobíme císlom 100 %). Pre hmotnostný zlomok zložky A platí:
Súčet hmotnostných zlomkov všetkých zložiek zmesi je rovný jednej resp. 100 %.

Organická chémia je časť chémie zaoberajúca sa organickými zlúčeninami, ich získavaním, izoláciou z prirodných látok, štúdiom ich štruktúry, priebehom ich reakcií a možnosťami ich umelej prípravy, čiže štúdiom syntézy organických zlúčenín. Organická chémia sa zoberá neobmedzeným počtom zlúčenín založených na schopnosti atómu uhlíka utvárať rozličné reťazce a viacnásobné väzby. Veľké množstvo organických zlúčenín tvoria heterocyklické zlúčeniny. Delenie chémie na anorganickú a organickú je iba historické; organické zlúčeniny sa správajú a riadia tými istými chemickými zákonmi ako anorganické.
Názov organická chémia vznikol pôvodne z nesprávneho pochopenia skutočnosti, že všetky tieto látky súvisia so životom a dajú sa vytvoriť iba procesmi prebiehajúcimi v živých sústavách. Organická chémia zahŕňa takmer všetky zlúčeniny uhlíka s ostatnými prvkami (okrem tých najjednoduchších ako kyselina uhličitá či kyanovodík). V súčasnosti je známych asi 17 miliónov týchto zlúčenín a denne pribúdajú ďalšie. Patria k nim aj všetky látky dodnes poznaných životných foriem. Avšak ani zďaleka nie sú známe všetky v prírode sa vyskytujúce organické molekuly. Opakom je anorganická chémia, ktorá sa zaoberá všetkými ostatnými prvkami a ich zlúčeninami.
Zvláštne postavenie uhlíka sa zakladá na jeho štyroch väzobných elektrónoch, čím môže vzniknúť nepolárna väzba s jedným až štyrmi atómami uhlíka. Môžu vzniknúť lineárne alebo rozvetvené uhlíkové reťazce alebo cykly. Väzobný elektrón uhlíka, ktorý nie je obsadený iným uhlíkom, je naviazaný na vodík alebo iné prvky (predovšetkým kyslík, dusík, síru, fosfor). To často vedie k vzniku veľkých až veľmi veľkých molekúl a zároveň objasňuje obrovskú mnohorakosť organických molekúl. Podobná mnohorakosť by sa dala očakávať aj u kremíka, ktorý je tiež štvormocný.

Fritz Haber (* 9. december 1868, Vroclav, vtedy Prusko – † 29. január 1934, Bazilej) bol nemecký chemik, ktorý v roku 1918 získal Nobelovu cenu za chémiu za syntetizovanie amoniaku, ktorý je dnes dôležitou surovinou na výrobu umelých hnojív a výbušnín.
V rokoch 1886 - 1897 študoval na Univerzite v Heidelbergu pod vedením Roberta Bunsena, na Univerzite v Berlíne v skupine Augusta Wilhelma von Hoffmanna a na Technickej Univerzite v Charlottenburgu (dnes Technická Univerzita v Berlíne) pod vedením Carla Liebermanna. V roku 1901 sa oženil s priateľkou Clarou Immerwahrenovou. Pred tým ako začal vyučovať, pracoval v otcovej chemickej továrni a v Technologickom Inštitúte v Zürichu spolu s Georgom Lungem. Napriek tomu, že konvertoval z Judaizmu, naďalej ho považovali za Žida a v roku 1933 musel emigrovať z Nemecka. Pár mesiacov strávil v Cambridge a zvažoval, že prijme post v meste Rehovot v Palestíne (dnes Izrael), ale nikde nepobudol dlho. Zomrel na infarkt v hoteli v Baseli.
Počas pôsobenia v Karlsruhe spolu s Carlom Boschom navrhli takzvaný Haberov proces (alebo Haber-Boschov proces) na syntézu amoniaku z vodíka a atmosferického dusíka za pomoci katalyzátora a za vysokého tlaku a teploty. V roku 1918 získal za tento objav Nobelovu cenu za chémiu. Haber-Boschov proces bol míľnikom v priemyselnej chémii pretože dusíkaté látky sa už nemuseli získavať z prírodných zdrojov ako napríklad čílsky liadok. Má sa za to, že tento objav procesu výroby amoniaku odvrátil maltuziánsku krízu. Zaoberal sa tiež výskumom reakcií počas horenia, separáciou zlata z morskej vody, mechanizmami adsorpcie a elektrochémiou. Veľkú časť svojich prác urobil v rokoch 1911 až 1933 na Inštitúte fyziky a elektrochémie v Berlíne.

2,4,6-trinitrofenol alebo kyselina pikrová je staršia výkonná trhavina, na vojenské použitie. V súčasnosti sa už takmer nepoužíva. Je určite zaujímavé, že soli kyseliny pikrovej poznali už alchymisti - v alchymistickom spise z roku 1742 je popísaná príprava pikrátu olovnatého a pikrátu draselného.
Kyselina pikrová tvorí biele až nažltlé kryštáliky. Vo vode je málo rozpustná, pri 20°C sa v 100 g vody rozpustí 1,1 g TNF, pri 100°C 7,25 g. Je málo hydroskopická. Dobre sa rozpúšťa v organických rozpúšťadlách, predovšetkým v acetóne (43 g v 100 g pri 25°C), metylalkohole (21 g v 100 g pri 25°C), málo sa rozpúšťa v kyseline sírovej a kyseline dusičnej pri izbovej teplote, rozpustnosť s teplotou rastie. Pri zahriatí nad teplotu topenia (122,5°C) začína sublimovať.
Kyselina pikrová má kyslú povahu. Voči kyselinám je pomerne stála. So zásadami vytvára pikráty (soli kyseliny pikrovej), ktoré sú značne citlivé a patria medzi traskaviny. So stúpajúcou atómovou hmotnosťou kovu citlivosť pikrátov rastie. S kovmi za prítomnosti vody alebo v roztavenom stave tiež vytvára pikráty. Kyselina pikrová s obsahom pikrátov je manipulačne nebezpečná. Kyselina pikrová vytvára aj estery, napríklad trinitroanizol a trinitrofenetol.
Kyselina pikrová je jedovatá viac ako aromatické nitrolátky. Jednorázová smrteľná dávka pre králika je asi 0,5 g na 1 kg živej váhy, zhromažďuje sa v tele. Preniká aj pokožkou; kožu, vlasy, nehty, zuby a sliny farbí na žlto. Slabý roztok kyseliny pikrovej (0,05 %) zabíja do pol hodiny mnohé baktérie (napríklad aj baktérie týfusu).

Zyklon B (doslova Cyklón B) je obchodný názov pesticídu nemeckej firmy IG Farben, ktorý je známy tým, že ho používal nacistický režim počas holokaustu v 2. svetovej vojne. Zyklon B je granulovaná kremelina nasýtená kyanovodíkom, z ktorej sa po otvorení obalu začne uvoľnovať plynný kyanovodík (HCN). Spočiatku sa používal na dezinfekciu a dezinsekciu, ale od roku 1941 sa začal Zyklon B používať ako nástroj genocídy v plynových komorách v koncentračných táboroch. Zyklon B sa skladuje vo vzduchotesných kontajneroch. Produkcia Zyklonu B v Kolíne v Česku ďalej pokračuje pod zmeneným obchodným názvom Uragan D2.
Zyklon B sa používal v koncentračných táboroch proti všiam, ako opatrenie na zastavenie šírenia týfu. Zyklon B dodávali firmy Degesch (Deutsche Gesellschaft für Schädlingsbekämpfung GmbH - Nemecká spoločnosť na boj proti škodcom s.r.o.) z Frankfurtu nad Mohanom a Testa (Tesch und Stabenow, Internationale Gesellschaft für Schädlingsbekämpfung m.b.H.) pod licenciou IG Farben.
Nacistický režim nariadil v rozpore s platnými nemeckými zákonmi vyrábať Zyklon B bez výstražného odorantu a iritantu (metylester kyseliny brómoctovej a/alebo chlórpikrín). Dvoch riaditeľov firmy Tesch odsúdil po vojne britský vojenský súd za spoluvinu pri dodávke chemikálie na trest smrti. Iróniou osudu je, že Zyklon B vyvinul v 20. rokoch 20. storočia Fritz Haber, nemecký žid, ktorý emigroval v roku 1934.

Kovalentná väzba (z lat. co- = súčasne, valere = vládnuť) je typ chemickej väzby, ktorá vzniká medzi dvoma atómami, ktoré majú jeden alebo viac nespárených elektrónov a ich rozdiel elektronegativít je malý. Kovalentná väzba je silnejšia ako vodíková väzba a je približne rovnako silná ako iónová väzba.
Pri tvorení väzby sa elektrónové oblaky nespárených elektrónov navzájom prekryjú a splynú. Spoločný elektrónový oblak sprostredkuje väzbu medzi atómami. Tým si atómy doplnia počet elektrónov zvyčajne na taký, aký majú atómy najbližšieho vzácneho plynu v periodickej tabuľke.
Napríklad zlúčením dvoch atómov vodíka vzniká molekula vodíka H2, v ktorej je spoločný dvojelektrónový orbitál patriaci obidvom atómom. Pri vodíku sa prekrývajú dva orbitály typu s (s—s). Oba atómy majú potom taký elektrónový obal ako atóm najbližšieho vzácneho plynu - hélia.
Podobne môže vzniknúť väzbový molekulový orbitál prekrytím a splynutím jednoelektrónových orbitálov p—p, ako je to napríklad pri zlučovaní dvoch atómov chlóru na molekulu Cl2. Splynutím jedného orbitálu s a jedného orbitálu p môže vzniknuť napríklad kovalentná väzba medzi vodíkom a chlórom - vzniká chlorovodík (HCl).
Pri vzniku zlúčenín kovov vedľajších podskupín sa uplatňujú pri tvorení kovalentnej väzby aj orbitály d predposlednej elektrónovej vrstvy, takže môžu vznikať väzbové molekulové orbitály s—d, p—d, d—d.

Kyslý dážď vzniká následkom úniku oxidu siričitého a oxidov dusíka do atmosféry, kde prejdú chemickými premenami a sú rozpustené v kvapkách vody v oblakoch. Kvapky padajú na zem vo forme dažďa, alebo snehu, čo môže zvýšiť kyslosť pôdy a ovplyvniť chemickú rovnováhu v jazerách a vodných tokoch. Pojem kyslý dážď je niekedy pouužitý vo všeobecnejšom význame, ktorý zahŕňa všetky formy kyslého spádu - mokrý spád, kedy kyselinotvorné plyny a častice sú splachované dažďom a inými zrážkami, a suchý spád, keď sa plyny a častice ukladajú na povrch Zeme bez prítomnosti zrážok.
Počiatkom 19.storočia, vynálezca menom Janakan objavil chemickú podstatu kyslého dažďa. Zistil, že kyslý dážď sa dá definovať ako akýkoľvek výskyt zrážok s neobvykle nízkou hodnotou pH. Pri typickej koncentrácii CO2 vo vzduchu sa oxid uhličitý rozpúšťa vo vode za vzniku slabej kyseliny uhličitej, s hodnotou pH približne 5,6. Preto sa kyslý dážď niekedy definuje hodnotou pH < 5.6. Prirodzené zdroje kyslosti však spôsobujú, že v rôznych oblastiach sú hodnoty pH dažďa v rozsaju 4.5 až 5.6 s priemernou hodnotou 5.0, takže dážď s hodnotou pH < 5 je vhodnejšou definíciou.
Kyslý dážď urýchľuje zvetrávanie uhličitanových hornín a urýchľuje aj koróziu budov. Prispieva tiež ku kyslosti riek, potokov a ničí stromy vo vyšších polohách. Na boj s týmto javom sa vynakladá v súčasnosti značné úsilie.

Mydlo je tenzid používaný v kombinácii s vodou na umývanie a pranie. Zvyčajne je dostupné vo forme lisovaných zvyčajne zaoblených tehličiek. Postupne sa rozšírilo aj aj používanie tekutého mydla, najmä v podávačoch verejných umyváriek. Po aplikácii na na povrch tuhého telesa udržje mydlo dokáže udržať častice v suspenzii, takže môžu byť spolu s vodou spláchnuté. V rozvinutých krajinách nahradili pri praní prádla mydlo syntetické detergenty.
Mydlá sú zvyčajne zmesi sodných a draselných solí mastných kyselín. Môžu byť vytvorené z olejov a tukov reakciou s hydroxidmi ako hydroxid sodný a draselný pri teplotách 80-100°C v procese zvanom zmydelňovanie. Pôsobením lúhu sú v tuku hydrolyzované triacylglyceroly za vzniku glycerolu a surové mydlo. Historicky sa využíval najmä hydroxid draselný, získavaný z popola spálenej rastlinnej alebo drevnej hmoty. Mydlo je vyrábané z olejov alebo z tuku. Pojem mydlo je v užívaný tak bežne, že sa používa aj pre mnohé čistiace prostriedky, ktoré neobsahujú mydlo.
Aj keď je pojem „mydlo“ je bežný v každodennej konverzácii, v skutočnosti je väčšina druhov "mydiel" tvorená syntetickými detergentmi, ktoré sú lacnejšie a jednoduchšie vyrábané. Napriek snahe zmierniť dopad na životné prostredie boli úspechy v tomto ohľade skromné.
Mydlo je užitočné pri umývaní, pretože molekuly mydla sa dobre viažu s nepolárnymi molekulami (napr. tuk, olej) a polárnymi molekulami (ako voda). Mastné látky zvyčajne adherujú na povrchy ako je koža alebo oblečenie. Molekuly mydla adherujú na mastnotu a pôsobia ako ručka, ktorá umožní spláchnutie mastnosty vodou. Ak sa nechá mydlo dlho pôsobiť na niektoré povrchy ako pokožka alebo tkaniny, môže narušiť rovnováhu obsahu vlhkosti v nich a spôsobiť rozpad tkaniny respektíve suchosť pokožky.

Bór (lat. borum) je chemický prvok v periodickej tabuľke prvkov, ktorý má značku B a protónové číslo 5. Patrí medzi nekovové prvky (ako jediný prvok z 13. skupiny) a vyskytuje sa v dvoch modifikáciách, ako amorfný a kryštalický. Kryštalický bór je veľmi tvrdý, po uhlíku (diamante) je to druhý najtvrdší prvok periodickej tabuľky. Elektrónová konfigurácia atómu bóru je 1s2 2s2 2p1, v zlúčeninách sa vyskytuje väčšinou v oxidačnom stupni 3. Bór a jeho zlúčeniny intenzívne sfarbujú plameň dozelena. Tento jav sa využíva na prípravu zmesí pre pyrotechnické účely a v analytickej chémii slúži ako dôkaz prítomnosti bóru v analyzovanej vzorke.
Bór sa vyskytuje v troch modifikáciách, základom ich štruktúry je ikozaéder B12. Atómy bóru sú v ikozaédri pospájané so susedmi piatimi delokalizovanými väzbami. Jednotlivé modifikácie sa líšia usporiadaním ikozaédrov v kryštálovej štruktúre, prípadne aj prítomnosťou iných zoskupení (B6, B10), prípadne aj prítomnosťou jednotlivých atómov bóru.

Linus Carl Pauling (* 28. február 1901, Portland, Oregon, USA – † 19. august 1994, Big Sur, Kalifornia) bol americký fyzik a biochemik, široko známy ako chemik 20. storočia.
Pauling bol priekopníkom kvantovej mechaniky v chémii. V roku 1954 získal Nobelovu cenu za chémiu za svoj výskum podstaty chemickej väzby. Bol tiež dôležitou osobou pri určovaní bielkovinovej štruktúry a bol jedným zo zakladateľov molekulárnej biológie. Pauling je známy ako všestranný bádateľ v anorganickej chémii, organickej chémii, metalurgii, imunológii, anesteziológii, psychológii, výskume rádioaktívneho rozpadu a vo výskume následkov použitia atómových zbraní. V roku 1962 získal za svoju kampaň proti pozemnému testovaniu nukleárnych zbraní Nobelovu cenu za mier, čím sa stal jedným z nositeľov dvoch Nobelových cien. Neskôr sa stal propagátorom pravidelného požívania veľkých dávok Vitamínu C.

DNA-polymeráza sú enzýmy participujúce na syntéze DNA, ktoré sa podieľajú na jej samotnej replikácii. Poznáme DNA polymerázu I, II a III. DNA ligázy katalyzujú spojenie fosfodiesterových väzieb.
Katalyzuje postupné pripojovanie deoxyribonukleotidov k volnej 3-OH skupine 3-konca úseku novovznikajúcej DNA, ktorý sa predlžuje. Deoxyribonukleotidy pripojuje na začiatok priméru, nasyntetizovaného úseku RNA ktorý sa ako prvý pripevní na kodogénne vlákno — vlákno ktoré sa syntetizuje, teda templát. Pre funkciu DNA polymerázy I je nevyhnutná prítomnost Mg2+ iónov. DNA polymeráza I nukleofilne atakuje 3-OH koniec priméru (štartéru) na atóm fosforu dNTP (deoxyribonukleotidu-5-fosfátu). Tvorí sa fosfodiesterová väzba a uvolní sa pyrofosfát (O-P-P-O), ktorý môže byť ďalej premenený na anorganický fosfát.
Najdôležitejšou vlastnosťou DNA polymerázy je, že pripája deoxyribonukleotidy v takom poradí, ktoré priamo určuje templát. DNA polymeráza I pôsobý tiež ako exonukleáza. Enzým sa podieľa na rozštiepený dvojzávitnice DNA a na hydrolytickom odbúravaný reťazca DNA od 3-OH konca článok po článku. Ide teda o 3→5 exonukleázu. Táto exonukleázova aktivita významne napomáha k spresneniu replikácie DNA.
DNA polymeráza I tiež hydrolyzuje DNA od 5-OH konca reťazca. Tato 5→3 nukleázova aktivita je však celkom odlišna od 3→5 exonukleázovej aktivity. Štiepenie prebieha vnútri reťazca v dvojzávitnicovej oblasti. Táto funkcia je klúčová, pretože odbúrava primér. Okrem toho sa opravujú niektoré poruchy.

Rádioaktivita (alebo Rádioaktívny rozpad alebo jadrový rozpad) je proces, pri ktorom nestabilné atómy strácajú svoju energiu vyžarovaním radiácie (žiarenia) vo forme častíc alebo elektromagnetických vĺn. Výsledkom rozpadu je premena atómu jedného typu, nazývaného rodičovský nuklid, na atóm iného typu, nazývaného aj detský nuklid. Napríklad uhlík-14 (rodič) emituje žiarenie a premieňa sa na dusík-14 (dieťa). Tento proces je na atómovej úrovni náhodný v tom zmysle, že nie je možné predpovedať, kedy sa určitý atóm rozpadne, ale v dostatočne veľkej vzorke podobných atómov vieme predpovedať priemernú dobu rozpadu.
Rádioaktivitu objavil v roku 1896 Henri Becquerel pri študovaní uránu. K objasneniu podstaty rádioaktivity zásadným spôsobom prispeli francúzski fyzici Pierre a Maria Curieovci. Prírodná rádioaktivita sa dá pozorovať pri prvkoch s protónovým číslom vyšším ako 81. Pri rozpade atómového jadra sa vyžiari energia a vznikne niekoľko atómov iných prvkov s nižšími atómovými číslami. Tieto sa prípadne môžu rozpadať ďalej, až kým nedospejú ku konečnému stabilnému prvku, ktorým bývajú zvyčajne rozličné izotopy olova. Polčasy rozpadu prvkov sú rôzne: od sekúnd až po 1010 rokov. Pomocou umelej rádioaktivity možno vytvárať prvky nevyskytujúce sa vo voľnej prírode, prípadne prvky s atómovým číslom vyšším ako 92 (medicínske účely, výskum).
Vitalizmus (z lat. vita – život) je filozofický smer (najmä v biológii), ktorý tvrdí, že na vznik a trvanie životných prejavov je potrebná tvorivá, nemateriálna až nadprirodzená sila nazývaná životná sila (lat. vis vitalis), entelechia, duša a podobne. Je to opak mechanicizmu. Počiatky smeru nájdeme u Platóna (učenie o duši) a Aristotela (učenie o entelechii), ale ako koncepcia vznikol vitalizmus až v 17. – 18. storočí.
Zmienka o tom, že telesné funkcie sú dôsledkom vitalistického princípu existujúceho vo všetkých živých organizmoch, má korene siahajúce prinajmenšom do rokov 384 pred Kr. – 322 pred Kr. Kým vitalistické myšlienky sa stali bežnými v tradičnej medicíne, pokusy vytvoriť funkčné vedecké modely sú datované od 17. storočia, kedy sa argumentovalo, že hmota existuje v dvoch radikálne rôznych formách, čo bolo odpozorované od ich správania v súvislosti s teplom. Tieto dve formy hmoty boli nazvané organická hmota a anorganická hmota. Anorganická hmota mohla byť roztopená a do pôvodného stavu vrátená odobraním tepla. Organické zlúčeniny boli zohrievaním premenené na nové formy, ktoré nemohli byť vrátené do pôvodného stavu (ireverzibilný dej). Tvrdilo sa, že podstatný rozdiel medzi týmito dvomi druhmi hmoty je vo vitálnej sile, ktorá mala byť prítomná len v organickej hmote.
Vynálezom mikroskopu v 16. storočí bola podporená teória, podľa ktorej príčinou chorôb sú mikroorganizmy. Taktiež lepším pochopením funkcie orgánov v ľudskom tele sa udržiavanie života stalo pochopiteľnejšie, čím sa redukovala potreba vysvetlovať životné pochody v termínoch „vitálnych síl“. Aj napriek tomu, vitalistické myšlienky boli stále podľa mnohých vedcov nevyhnutné k vysvetleniu ako organizmy udržujú život. Flogistonová teória, ktorá bola rozvinutá J. J. Becherom a G. Stahlom na konci 17. storočia tvrdila, že všetky horľavé materiály obsahujú flogiston, substanciu bez farby, pachu, chuti alebo hmotnosti, ktorá sa uvoľňuje pri horení. Po zhorení sa myslelo, že látka zbavená flogistonu, je vo svojej „pravej“ forme nazývanej calx.

Meskalín alebo 3,4,5-trimetoxyfenyletylamín je psychoaktívny alkaloid. Pre jeho halucinogénne účinky ho používali severoamerickí indiáni v Mexiku pri náboženských ceremóniách. Získava sa z kaktusov rodu Lophophora (peyotl, peyote) alebo sa syntetizuje umelo. Najznámejší z rodu je Lophophora williamsii. Ďalším zdrojom prírodného meskalínu môže byť kaktus Trichocereus pachanoi.
Meskalín bol prvýkrát izolovaný a identifikovaný v roku 1897, v roku 1919 ho syntetizoval nemecký chemikom Arthur Heffter. Názov alkaloidu vznikol z anglického označenia mezcal buttons, pod ktorým sa predávali sušené rastové vrcholy kaktusov Lophophora. Išlo o zámenu, pretože slovo mexcalli v reči Nahuatl znamená „opojný nápoj zo šťavy agáve“.
V prípade, že je vyčistený alebo vyrobený umelo, je to biely až žltkastý, jemne kryštalický prášok. Chemická štruktúra meskalínu je podobná adrenalínu, noradrenalínu a dopamínu. Zvyčajne sa syntetizuje z 3,4,5-trimetoxybenzaldehydu.
Účinná dávka pre človeka je 200–400 miligramov (3,75 mg/kg), s účinkom trvajúcim niekedy až 12 hodín. Po požití meskalínu nevzníká fyzická drogová závislosť. V roku 1970 sa v USA stala zakázanou látkou a v roku 1971 na celom svete, bola kategorizovaná ako halucinogén. Ľudia ktorí požili meskalín hovoria o vizuálnych halucináciach a radikálnych zmenách vedomia, často považované ako príjemné a osvietenské, ale občas sprevádzané pocitom úzkosti.

Teplota topenia alebo teplota tavenia je teplota, pri ktorej látka mení skupenstvo z tuhého na kvapalné. Kryštalická látka, ktorá sa skladá z jediného prvku, alebo jedinej zlúčeniny má svoju charakteristickú teplotu topenia. Celá premena z tuhej látky na kvapalnú prebehne pri konštantnej teplote. Kryštalické látky z viacerých fáz (zliatina) alebo amorfné látky (sklo, keramické látky, termoplasty, tuky) nemajú určitú teplotu topenia, mäknú a menia sa na kvapalinu v rozmedzí určitých teplôt tzv. intervale tavenia. Teplota topenia mierne závisí od tlaku, menej ako teplota varu. Chemickým prvkom s najvyššou teplotou topenia je volfrám - 3410°C. Naproti tomu hélium existuje v tuhom skupenstve iba pri teplotách blízkych absolútnej nule a tlaku 20 krát vyššom ako je atmosférický.
Teplota tuhnutia je teplota zmeny skupenstva v opačnom smere: z kvapalného na tuhé skupenstvo. Mnohé látky majú teplotu topenia a tuhnutia rovnakú, pri niektorých sa vyskytuje rozdiel, ktorý sa nazýva hysterézou.
Pri zliatinách je teplota (interval teplôt) tavenia závislá od zloženia zliatiny. Pri zliatinách dvoch v sebe úplne rozpustných zložiek plynulo prechádza od teploty tavenia jednej k teplote tavenia druhej. Pri zliatinách s čiastočnou rozpustnosťou, alebo s úplnou nerozpustnosťou, ktoré tvoria eutektikum je vo väčšine prípadov táto teplota pre akékoľvek zloženie nižšia ako teplota tavenia čistých zložiek z ktorých je zliatina zložená. Minimum sa dosiahne práve pri eutektickom zložení, pri ktorom sa zároveň interval teplôt zúži na jednu teplotu tzv. eutektický bod. Napríklad pre zliatinu železa s uhlíkom platí:
- teplota tavenia čistého železa - 1539°C
- interval teplôt tavenia zliatiny s 0,4 % uhlíka - 1460°C až 1502°C
- teplota tavenia zliatiny so 4,3 % uhlíka (eutektikum) - 1147°C
- interval teplôt tavenia zliatiny s 6,67 % uhlíka (cementit) - 1147°C až 1800°C
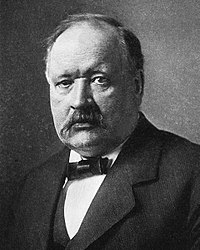
Svante August Arrhenius (* 19. február 1859, Uppsala – † 2. október 1927, Štokholm) bol švédsky fyzik a chemik, jeden zo zakladateľov fyzikálnej chémie a chemickej termodynamiky. V roku 1903 získal Nobelovu cenu za chémiu ako uznanie za výnimočné služby, ktoré poskytol pri pokroku v chémii svojou elektrolytickou teóriou disociácie.
Arrhenius sa narodil vo obci Vik pri Uppsale, Švédsko, ako syn Svante Gustava a Carolina Thunberg Arrheniusových. Jeho otec bol zememerač na Univerzite v Uppsale, kde sa dostal až na kontrolnú pozíciu. Keď mal Svante 3 roky, napriek rodičovským prianiam, sa naučil čítať pozorovaním otcových prác s číslami a jeho kníh, a tým sa stal aritmetickým zázračným dietaťom. V ranom veku, Arrhenius si osvojil používanie širokých vedomostí na objasnenie matematických vzťahov a zákonov. Vo veku 8 rokov, začal navštevovať miestnu katolícku školu rovno od 5. ročníka. Vyznačoval sa neobvyklým nadaním vo fyzike a matematike a zmaturoval ako najmladší a najtalentovanejší študent v roku 1876. Bol ženatý dvakrát. Prvýkrát so Sofiou Rudbeckovou (ktorá mu porodila syna) od 1894 do 1896 a druhýkrát s Mariou Johanssonovou (ktorá mu porodila syna a dve dcéry) od 1905 až do smrti.
Na univerzite v Uppsale bol nespokojný s hlavným profesorom fyziky a s jediným členom fakulty, ktorý by ho vedel viesť v chémii. Preto začal študovať na Fyzikálnom inštitúte na Švédskej akadémii vied v Štokholme u profesora fyziky Erika Edlunda v roku 1881. Svoju prácu upriamil na vodivosť elektrolytov. V roku 1884, na základe tejto práce, napísal 150 stranovú dizertačnú prácu o vodivosti elektrolytov na Univerzitu v Uppsale. Profesorov to však nezaujalo a tak dostal najnižšie možné hodnotenie. Neskôr, vďaka tejto práci, získal Nobelovu cenu za chémiu.

Striebro, chemická značka Ag (lat. Argentum) je ušľachtilý kov bielej farby, používaný človekom už od staroveku. Vyznačuje sa najlepšou elektrickou a tepelnou vodivosťou zo všetkých známych kovov. Slúži ako súčasť rôznych zliatin. Je vhodné na použitie v elektronickom priemysle, pri výrobe CD aj DVD nosičov a v šperkárstve. Jeho zlúčeniny sú potrebné pre fotografický priemysel.
Striebro je jeden z prvkov známych už od staroveku. Z bežných kovov má najlepšiu elektrickú a tepelnú vodivosť. Z mechanickej a metalurgickej stránky je veľmi dobre spracovateľné – má dobrú kujnosť a dobre sa odlieva (dobrá zatiekavosť). Patrí medzi prechodné prvky, ktoré majú valenčné elektróny v d orbitale. V zlúčeninách sa vyskytuje hlavne v oxidačnom čísle AgI. Zlúčeniny striebornatého katiónu (Ag+2) sú nestále a majú silné oxidačné účinky. Napriek tomu, že stiebro patrí medzi drahé kovy, ktoré sa vyznačujú silnou chemickou stabilitou, veľmi dobre reaguje s kyselinou dusičnou hlavne vďaka jej silným oxidačným schopnostiam. Reakcia prebieha podľa rovnice:
- 3 Ag + 4 HNO3 → 3 AgNO3 + NO + 2 H2O
Podobne sa striebro chová i voči koncentrovanej kyseline sírovej, ktorá pôsobí tiež oxidačne. Voči zriedenej H2SO4 je však striebro odolné, podobne ako pri pôsobení ďalších minerálnych kyselín. Za prítomnosti kyslíka sa sriebro rozpúšťa aj v roztokoch alkalických kyanidov za vzniku komplexného kyanostrieborného iónu Ag(CN)2-. Na suchom čistom vzduchu je striebro neobmedzene stále. Stačí však aj veľmi nízke množstvo sírovodíka (H2S), aby striebro začalo černieť, pretože na jeho povrchu vzniká vrstva sulfidu strieborného Ag2S.

Ozón je plyn, ktorého molekula sa skladá z troch atómov kyslíka.
Okrem zvyčajných dvojatómových molekúl O2 sa kyslík vyskytuje aj vo forme trojatómovej molekuly ako ozón O3. Za normálnych podmienok je to vysoko reaktívny plyn modrej farby a charakteristického zápachu s mimoriadne silnými oxidačnými účinkami. Pri teplote -112 °C kondenzuje na kvapalný tmavomodrý ozón a pri teplote -193 °C sa tvorí červenofialový tuhý ozón.
Ozón možno pomerne ľahko vyrobiť tichým elektrickým výbojom v atmosfére čistého kyslíka. Vzniká tak zmes kyslíka s ozónom, v ktorej podiel O3 dosahuje zvyčajne 10 %. Čistý ozón je možné pripraviť frakčnou destiláciou tejto plynnej zmesi. Praktické využitie ozónu je dané jeho silnými oxidačnými účinkami.
- V medicíne slúži na sterilizáciu nástrojov. Diskutabilné sú účinky dnes pomerne populárnej ozónovej terapie, ktorá by podľa svojich zástancov mala viesť k regenerácii buniek a tkanív. Odporcovia tejto metódy poukazujú na možné riziká podobných omladzovacích kúr, dané najmä vysokou reaktivitou a toxicitou ozónu.
- Baktericídne účinky ozónu slúžia na dezinfekciu pitnej vody namiesto v minulosti veľmi využívanej dezinfekcii vody plynným chlórom alebo chlórnanom.
- Silné oxidačné účinky ozónu sa veľmi často využívajú v papierenskom priemysle na bielenie celulózy na výrobu papiera.

Periodický zákon, opakovanie vlastností prvkov po istých periódach vyvodil 6. marca 1869 Dmitrij Ivanovič Mendelejev. Zákon v dnešnej úprave znie:
Vlastnosti chemických prvkov a ich zlúčenín sú v periodickej závislosti od protónového čísla ich atómov.
Rozumieme pod tým to, že fyzikálne a chemické vlastnosti prvkov závisia od štruktúry ich atómov a zákonite sa menia so zmenou ich protónového čísla. Niektoré typické vlastnosti prvkov sa po určitom počte prvkov v rade za sebou (po istých periódach) opakujú.
Periodický zákon má svoju fyzikálnu podstatu v periodicky pravidelných zmenách elektrónovej konfigurácie so stúpajúcim protónovým číslom. Týka sa to predovšetkým elektrónov vo valenčnej vrstve. Chemická periodicita je hlavným pojmom pri štúdiu anorganickej chémie a periodickej tabuľke sa nevyrovná žiadne iné zovšeobecnenie. Keď sledujeme postupnú výstavbu elektónových obalov atómov jednotlivých prvkov, zoradených v smere ich rastúcich atómových čísel (prirodzený rad kovov), zistíme, že jestvujú skupiny prvkov, pri ktorých vonkajšie elektónové vrstvy atómov majú analogickú štruktúru. Súčasne pozorujeme, že prvky týchto skupín sa vyznačujú nápadne podobnými chemickými vlastnosťami. Najvýhodnejšia pre náš účel je tzv. dlhá forma s oddelenými skupinami lantanoidov a aktinoidov.
V roku 1896, to je asi 25 rokov po pôvodnej práci D.I. Mendelejeva o chemickej periodicite, objavil J. J. Thompson všadeprítomný elektrón. Zistilo sa, že existuje súvis práve medzi e- a mocenstvom, či chemickou väzbou. Dnešné pohľady na elektrónovú štruktúru atómov sú založené na veľkom množstve experimentálnych výsledkov a na teoretických modeloch. Stručne sa dá povedať, že sa atóm skladá z centrálneho, ťažkého, kladne nabitého jadra, obklopeného riedkym obalom záporných elektrónov. Jadro je zložené z neutrónov (10n) a protónov (11p) približne rovnakej hmotnosti, tesne spojených silovým poľom mezónov. Konfigurácia elektrónov v atóme je popísaná štyrmi kvantovými číslami. Hlavné kvantové číslo n určuje celkovú energetickú hladinu. Orbitálne (vedľajšie) kvantové číslo l definuje tvar elektrónového oblaku a orbitálny uhlový moment. Tretie kvantové číslo sa nazýva magnetické kvantové číslo m a určuje smer uhlového momentu vo vnútri atómu pri pôsobení vonkajšieho magnetického poľa. Štvrté kvantové číslo ms sa nazýva spinovým magnetickým kvantovým číslom. Pretože chemické vlastnosti prvkov odvodzujeme z ich elektrónovej konfigurácie, a to hlavne z konfigurácie najslabšie viazaných elektrónov, môžeme chemickú periodicitu a tvar periodickej tabuľky ľahko interpretovať pomocou elektrónovej štruktúry.
Deoxyribonukleová kyselina alebo DNK alebo DNA (angl. deoxyribonucleic acid) patrí spolu s kyselinou ribonoukleovou medzi nukleové (jadrové) kyseliny. Nukleové preto, lebo sa nachádza predovšetkým v bunkovom jadre. DNA je nositeľkou genetickej informácie bunky, riadi rast a regeneráciu bunky. V chromozómoch je DNA uložená ako špirála - dvojzávitnica.
DNA je polymérna molekula tvorená nukleotidmi, ktoré pozostávajú z troch zložiek:
- fosfátového zvyšku kyseliny fosforečnej (PO43−),
- molekuly deoxyribózy,
- dusíkatej bázy.
Dusíkaté bázy sú štyri: adenín (A), guanín (G), cytozín (C) a tymín (T). Spájajú obe vlákna dvojzávitnice DNA pomocou vodíkových väzieb, pričom platí princíp tzv. komplementarity báz. Znamená to, že adenín sa spája, teda je komplementárny s tymínom (dvomi vodíkovými väzbami) a guanín sa spája s cytozínom (tromi vodíkovými väzbami).
Úlohou DNA je uchovávať a odovzdávať genetickú informáciu (o poradí aminokyselín v bielkovinách), ktorá je zapísaná v jej primárnej štruktúre. Prenos genetickej informácie na molekulovej úrovni prebieha jedným smerom a v troch procesoch: replikácii, transkripcii a translácii.
Väčšina génov potrebných pre život sa nachádza v eukaryotických bunkách – v jadre, mitochondriách a v chloroplastoch na chromozómoch. V prokaryotických organizmoch sa nachádza na plazmidoch doplnková genetická informácia. Na to aby mohla DNA plniť svoju funkciu musí byť schopná zdvojenia sa, čo sa uskutočňuje replikáciou – kopírovaním.
Pri vlastnej syntéze DNA sa obidve vlákna pôvodnej molekuly začnú od seba vzďaľovať a rozpletať (enzým helikáza). Voľné nukleotidy sa podľa princípu komplentarity (enzým DNA-polymeráza) začínajú prikladať k pôvodnému (matricovému) vláknu DNA (3’ → 5’), oproti druhému vláknu (5’→ 3’) syntetizuje DNA-polymeráza iba krátke fragmenty (tzv. Okazakiho fragmenty), ktoré následne spája enzým DNA-ligáza. Týmto spôsobom z jednej pôvodnej DNA vzniknú dve molekuly, z toho každá ma jedno vlákno pôvodné a jedno vlákno nové, tzv. semikonzervatívny spôsob.

Etanol (iné názvy: etylalkohol, alkohol, lieh) je bezfarebná horľavá kvapalina. Jej chemický vzorec je CH3-CH2-OH, často sa uvádza aj ako C2H5OH, sumárne C2H6O.
Najväčšia časť produkcie etanolu sa pripravuje z jednoduchých sacharidov (cukrov) alkoholickým kvasením pôsobením rôznych druhov kvasiniek, predovšetkým rôzných šľachtených kmeňových druhov Saccharomyces cerevisiae. Používa sa k tomu ako cukrový roztok (o maximálnej koncentrácii 20 %), tak aj priamo prírodné suroviny obsahujúce sacharidy, ako sú napr. zemiaky alebo trstina cukrová. Kvasný proces prebieha podľa sumárnej rovnice
- C6H12O6 → 2 C2H5OH + 2 CO2.
Kvalita takto získaného etanolu je veľmi závislá na východzej surovine; kvasením vzniká zápara, čiže veľmi zriedený vodný roztok etanolu (maximálne 15 %); vždy však obsahuje nežiaduce prímesi, zrejme vyššie alkoholy (propanol a izopropanol), viac sýtené alkoholy (glycerol), ketóny (acetón) aj. Čistenie sa uskutočňuje na výkonných destilačných kolónach, pričom možno získať tzv. absolútny alkohol, obsahujúci 95,57 % etanolu a 4,43 % vody. Zvyšok vody môžeme odstrániť destiláciou s bezvodným síranom vápenatým alebo oxidom vápenatým, ktoré vodu viažu alebo dlhodobým pôsobením hygroskopických látok ako napr. bezvodného uhličitanu draselného alebo bezvodného síranu meďnatého (modrej skalice). Týmito postupmi možno získať etanol o čistote až 99,9 %. Inou metódou získavania čo najčistejšieho etanolu je tzv. azeotropická metóda, spočívajúca v destilácii s prídavkom benzínu alebo benzénu, ktorou môžeme získať produkt o čistote až 99,7 %. Synteticky sa etanol pripravuje katalytickou hydratáciou eténu (etylénu)
- CH2=CH2 + H2O → C2H5OH
Ako katalyzátor sa používa kyselina trihydrogenfosforečná na oxide kremičitom. Takto pripravený etanol má oveľa menej nečistôt než kvasený a je preto kvalitnejší.
Ernest Rutherford, 1. barón Rutherford z Nelsonu (* 30. august 1871, Spring Grove, Nový Zéland – 19. október 1937, Cambridge, Spojené kráľovstvo) bol novozélandský v Británii žijúci jadrový fyzik. Je známy ako „otec“ jadrovej fyziky, priekopník orbitálnej teórie atómu, obzvlášť za jeho objav protónu z jadra pri jeho experimente so zlatou fóliou.
Rutherford sa narodil v Spring Grove, (dnes Brightwater), blízko Nelsonu. Študoval na Nelson College kde vyhral štipendium pre štúdium na Univerzitev v Cantarbury. Tu dosiahol tri tituly a pracoval tu dva roky na výskume popredne elektrickej technológie. V roku 1895 Rutherford odcestoval do Anglicka na postgraduálne štúdium v Cavendish laboratóriach na Cambridgskej Univerzite. Tu sa stal na krátku dobu držiteľom rekordu v diaľke, na ktorú bol schopný detegovať bezdrôtové vlny. Počas výskumu rádioaktivity zaviedol termíny alfa lúč, beta lúč a gamma lúč.
V roku 1898 bolo Rutherfordovi udelené kreslo fyzika na McGill Univerzite kde vykonával prácu, za ktorú v roku 1908 získal Nobelovu cenu za chémiu. Dokázal, že rádioaktivita je spontánny rozpad atómu. Toto je ironicky spomenuté v jeho poznámke „Z vied je len fyzika; všetko ostatné je zbieranie známok.“. Všimol si, že vzorke rádioaktívneho materiálu trvalo nemenne rovnakú dobu, kým sa polovica z nej rozpadla (jej polčas rozpadu) a vyvinul praktické použitie tohto javu ako hodiny, ktoré potom mohli byť použité na určenie skutočného veku Zeme, ktorý sa ukázal byť oveľa vyšší ako vedci v tej dobe predpokladali.
V roku 1907 zaujal kreslo fyzika na Univerzite v Manchesterery. Tam objavil jadrovú podstatu atómov a bol prvým úspešným „alchymistom“ na svete: zmenil dusík na kyslík. Počas spolupráce s Nielsom Bohrom (ktorý zistil, že elektróny sa pohybujú na špecifických orbitách) Rutherford teoretizoval o existencii neutrónov, ktoré by istým spôsobom kompenzovali odpudivý efekt kladného náboja protónov pôsobením príťažlivej jadrovej sily a tak zabraňovali rozpadu jadra.

Lúčavka kráľovská (lat. aqua regia) je zmes koncentrovanej kyseliny chlorovodíkovej (HCl) koncentrovanej kyseliny dusičnej (HNO3) (lat. aqua fortis), zvyčajne v objemovom pomere 3:1.
Je to žltkastá, dymivá kvapalina, mimoriadne silné oxidačné činidlo. Charakteristická pre lúčavku kráľovskú je jej krátka doba účinnosti. Po čase sa začne rozkladať a stráca účinok. Rozpúšťa mnoho ušľachtilých kovov vrátane zlata a platiny, ale napr. tantal a irídium sú voči nej odolné.
Zmes kyseliny dusičnej a kyseliny chlorovodíkovej rozpúšťa vzácne kovy, pretože každá z kyselín plní odlišnú funkciu. Kyselina dusičná je silné oxidačné činidlo, ktoré rozpustí nepatrné množstvo zlata za vzniku zlatitých katiónov (Au3+).
- Au + 3 NO3− + 6 H+ → Au3+ + 3 NO2 + 3 H2O (1)
Tie reagujú s chloridovým aniónom za vzniku tetrachlórzlatitého aniónu:
- Au3+ + 4 Cl− → AuCl4− (2)
Rovnováha tejto reakcie je silne posunutá v pravo, pretože chloridové anióny odoberajú zlatité katióny z prostredia, čím opätovne posúvajú rovnováhu reakcie (1) doprava a prebieha tak ďalšia oxidácia Au→Au3+.
Pri zmiešavaní koncentrovanej kyseliny chlorovodíkovej a koncentrovanej kyseliny dusičnej začne reakcia, pri ktorej začne unikať chlór a nitrozyl chlórny, ktorý spôsobuje zoslabenie účinkov kyseliny. Žltá farba, ktorá vzniká pri reakcii, je charakteristická pre túto kyselinu. Keď sa prchavé produkty uvoľňujú zo zmesi, aqua regia stráca schopnosť rozpúšťadla.
- HNO3 (l) + 3 HCl (l) → NOCl (g) + Cl2 (g) + 2 H2O (l)
Nitrozyl chlórny sa rozpadá na oxid dusnatý a chlór.
- 2 NOCl (g) → 2 NO (g) + Cl2 (g)
Preto lúčavka kráľovská dymí, t.j. vystupujú z nej pary chlóru a nitrozylu chlórneho, ktorý sa ďalej rozkladá na chlór a pary oxidu dusného.

Železo (lat. Ferrum) je chemický prvok v Periodickej tabuľke prvkov, ktorý má značku Fe a protónové číslo 26. Železo je pomerne mäkký, striebrosivý kov. Patrí medzi prechodné prvky. Chemicky je pomerne reaktívne, reaguje s kyselinami za uvoľnovania vodíka. Pôsobením vzdušnej vlhkosti a kyslíka sa oxiduje za vzniku zmesi hydratovaných oxidov a hydroxidov železa, nazývaných hrdza. Tento proces je veľký problém pre priemysel, nakoľko železo je jeden z najpoužívanejších kovov. Ako ochrana sa používajú rôzne nátery, pasivácia pôsobením kyseliny fosforečnej (vznik pevnej vrstvičky fosforečnanov), pokovovanie, atď.
Najbežnejší oxidačný stupeň zlúčenín železa je +2 a +3. Zo zlúčenín sú to najmä oxid železnatý (FeO), oxid železitý (Fe2O3), a podvojný oxid železnato-železitý (Fe3O4). Používajú sa najmä na výrobu čistého železa.
Železo ako prechodný prvok tvorí množtvo komplexov, v nich vystupuje najčastejšie v koordinačných číslach 4 a 6. Komplexy železa sú pomerne stabilné. Z najznámejších uvedieme hexakyanoželeznatan draselný (žltá krvná soľ) K4Fe(CN)6, hexakyanoželezitan draselný (červená krvná soľ) K3Fe(CN)6 - používané v analytickej chémii, a pentakarbonyl železa Fe(CO)5, používaný na laboratórnu prípravu čistého železa. Ďalšie používané zlúčeniny sú síran železnatý (FeSO4), chlorid železitý (FeCl3). Je známy aj výskyt oxidačných stupňov +4, +5, +6 (K2FeO4). Dané zlúčeniny sú veľmi silné oxidovadlá.
Železo je jedným z najrozšírenejších prvkov v zemskom telese (5 hm. %). Jeho distribúcia však nie je rovnomerná, smerom od povrchu k jadru jeho obsah narastá, samotné jadro je tvorené zliatinou niklu a železa v pomere ~85 % Fe: ~6 % Ni. V prírode sa železo vyskytuje v rôznych, najčastejšie mafických horninách - bazalt a mineráloch - pyroxény, amfiboly, olivín. Významné sú železné rudy: hematit, limonit, v magnetit, siderit a pyrit, z ktorých sa železo priemyslene vyrába.
Výskyt čistého železa je vzácny (niektoré náleziská v Grónsku a Švédsku). Nachádza sa aj tzv. železných meteoritoch, v podobe zliatin s niklom.

Lipidy (z gréc. slova lipos - tuk) sú látky rastlinného alebo živočíšneho pôvodu, málo rozpustné alebo nerozpustné vo vode. Lipidy sú estery vyšších karboxylových kyselín (nasýtených alebo nenasýtených) a alkoholov, respektíve ich derivátov. Patria do skupiny nepolárnych molekúl biogénneho pôvodu. Z biochemického hľadiska sú lipidy estery (prípadne zložené amidy) vyšších karboxylových kyselín (mastných kyselín) a alkoholov.
Nepolárnou zložkou lipidov sú vyššie monokarboxylové kyseliny. Môžu to byť
- alifatické nasýtené karboxylové kyseliny (zdrojom sú živočíšne tuky)
- s lineárnym reťazcom (
CH3-(CH2)n-COO−) - s rozvetveným reťazcom (kys. izovalérová
(CH3)2CH-CH2-COO−)
- s lineárnym reťazcom (
- alifatické nenasýtené karboxylové kyseliny
- s jednou dvojitou väzbou (kys. palmitoolejová)
- s dvomi dvojitými väzbami (kys. linolová)
- aromatické karboxylové kyseliny (kys. hydrokarpová)
- hydroxykarboxylové kyseliny (kys. ricínoolejová)
Najčastejšie sú to alifatické kyseliny s lineárnym reťazcom s párnym počtom atómov uhlíka - so 14 až 24 atómami. To je spôsobené tým, že sa v organizme syntetizujú pridávaním dvojuhlíkatých acetylových jednotiek, ktoré sa prenášajú v podobe acetylkoenzýmu A. Alifatické nenasýtené kyseliny v lipidoch mávajú 1 až 4 dvojité väzby, všetky v cis-konfigurácii. Dvojité väzby nie sú konjugované. Telo je schopné si neesenciálne mastné kyseliny syntetizovať, avšak esenciálne mastné kyseliny (nenasýtené mastné kyseliny) musí prijímať v potrave. Preto sa niekedy esenciálne mastné kyseliny označujú ako vitamíny F. Pôsobením tepla, svetla, vzduchu, prípadne mikroorganizmov sa tuky rozkladajú, vznikajú aldehydy, ketóny a kyseliny s menším počtom uhlíkov v reťazci molekúl.
Riboflavín (vitamín B2, vitamín G, ovoflavín, laktoflavín) je žlté až oranžovo-žlté prírodné flavínové farbivo slabo rozpustné vo vode. V potravinárstve sa značí ako E 101.
Riboflavín nie je citlivý na teplo, kyseliny ani oxidácie, ale neznesie svetlo, hlavne ultrafialové. Jeho spotreba stúpa v stresových situáciach. V spolupráci s enzýmami sa podieľa na metabolickej premene živín a získavaní energie pre bunku. Spolu s ďalšími vitamínmi (kyselina listová, pyridoxín, niacín) sa zúčastňuje produkcie hormónov v kôre nadobličiek. Vstrebáva sa veľmi dobre, viaže sa na proteíny plazmy. Malá časť sa ukladá v pečeni a v pľúcach. Riboflavín sa považuje za úplne netoxický, nie je mutagénny, teratogénny ani karcinogénny ani pri veľkých dávkach. Riboflavín sa z tela vylučuje prevažne močom (spôsobuje jeho žlté intenzívne zafarbenie), ale môže sa vylučovať aj potom.
Vo voľnej forme a vo forme nukleotidov sa riboflavín vyskytuje vo všetkých rastlinných a živočíšnych organizmoch. Väčšina rastlín a plodov obsahuje riboflavín vo veľmi malom množstve. Podstatne bohatším zdrojom sú kvasnice, mlieko, mäso, ryby. Zistilo sa, že pasterizáciou mlieka sa stráca 20% riboflavínu a čím je mlieko trvanlivejšie, tým menej riboflavínu obsahuje. Riboflavín obsahuje aj: droždie, pečeň, srdce, obličky, tvaroh, orechy.
Riboflavín je dôležitý pre dobrý stav kože, očí, funkciu srdca a ďalších orgánov. Má výrazný vplyv na metabolizmus sacharidov, lipidov a aminokyselín, ovplyvňuje celkovú energetickú premenu v organizme. Ako súčasť enzýmov v dýchacom reťazci je nevyhnutný pre základný bunkový metabolizmus. Je dôležitý pre červené krvinky, reguláciu rastu človeka a reprodukciu.
Denná spotreba riboflavínu je 1–1,2 mg. Vyššia je v období rastu, pri infekciách, po operáciach a úrazoch, v tehotenstve a v období kojenia, tiež pri zvýšenej činnosti štítnej žľazy a pri potrave s vyšším podielom tukov. Deficit riboflavínu sa môže prejaviť aj pri chorobe žlčníka, chronickom zápale tenkého čreva, pri cukrovke, pri používaní perorálnej antikoncepcie a pri terapii antidepresívami s tricyklickou štruktúrou. Vyššiu spotrebu majú fajčiari a ľudia konzumujúci alkohol. Riboflavín sa odporúča aj osobám trpiacim zvýšenou hladinou homocyesteínu.
Polymér je látka pozostávajúca z monomérov. Polyméry vznikajú polymeráciou, polykondenzáciou alebo polyadíciou. Voľakedy sa za polyméry označovali výhradne makromolekulové látky zložené z molekúl so všeobecným vzorcom Xn (kde X značí štruktúrnu jednotku, ktorá sa v molekule n-krát opakuje). Dnes sa bežne hovorí o polyméroch tiež pri bielkovinách (proteínoch) a nukleových kyselinách, pretože ich molekuly obsahujú veľký počet vzájomne si podobných, na sebe napojených štruktúrných jednotiek.
Typickým príkladom jednoduchého polyméru je polyetylén, ktorého vzorec je H―(CH2)n―H alebo H―(CH2―CH2)n―H (druhý zo vzorcov používame vtedy, keď chceme zdôrazniť vznik tejto zlúčeniny polymeráciou eténu (etylénu).
Iným príkladom uhľovodíkového polyméru môže byť polybutadién (najstarší umelý kaučuk) H―(CH2―CH═CH―CH2)n―H, resp. polybutadién ukončený hydroxylovou skupinou HO―(CH2―CH═CH―CH2)n―OH, jeho reťazce sú miesto vodíkového atómu zakončený hydroxylovou skupinou.
Príkladom zložitejšieho polyméru môže byť polyvinylchlorid (PVC) H―(CH2―CHCl)n―H.
Polyméry, uvedené v predchádzajúcich príkladoch, majú priame, nerozvetvené reťazce. Jednoduchým príkladom polyméru s rozvetveným reťazcom je prírodný kaučuk, ktorého monomérnou jednotkou je uhlovodík izoprén. Polymérne látky nemusia vytvárať len lineárne reťazce. Medzi jednotlivými reťazcami monomérnych jednotiek môžu vznikať vzájomné chemické väzby, vytvárajúce plošnú alebo aj priestorovú štruktúru molekúl polymérov.
Polyméry môžu tiež vznikať zo zmesi dvoch alebo viac monomérov. Vtedy hovoríme o kopolymerácii a vzniknutú látku označujeme ako kopolymér. Vzniknuté molekuly sa môžu vyznačovať pravidelným alebo nepravidelným striedaním monomérnych jednotiek. V tomto zmysle môžeme aj biekloviny(proteíny) a nukleové kyseliny považovať za kopolyméry.

Vodík (lat. Hydrogenium) je chemický prvok v Periodickej tabuľke prvkov, ktorý má značku H a protónové číslo 1. Vo voľnej prírode sa atómy vodíka nenachádzajú, pri zrode atómového vodíka sa okamžite spája do molekuly H2. Zaraďuje sa do prvej aj do siedmej skupiny periodickej sústavy, lebo má vlastnosti prvkov prvej aj siedmej skupiny. Latinský názov pochádza z gréčtiny (hydór = voda, gennaó = vytváram) a vymyslel ho Lavoisier. Slovenský názov je odvodený rovnakou logikou.
Vodík je najjednoduchší chemický prvok , je číry bezfarebný plyn bez chuti a zápachu. Je najľahší plyn vôbec (14,5 krát ľahší ako vzduch). Molekulárny vodík je pomerne stabilný a vďaka vysokej energii väzieb je takisto málo reaktívny. Pohybuje sa obrovskou rýchlosťou 1800 m/s. Jeho tepelná vodivosť je sedemkrát väčšia ako vzduchu. Molekuly sú extrémne malé a preto ľahko prechádzajú poréznymi látkami. Vo vode sa vodík rozpúšťa nepatrne: V 1 litri vody sa pri 0 °C a tlaku 0,1 MPa rozpustí 22 ml plynného vodíka. Lepšie sa rozpúšťa v nikli, paládiu a v platine. Pri rozpúšťaní v týchto kovoch sa molekuly vodíka štiepia na atómy. Atomárny vodík je reaktívnejší než molekulárny, preto reakcia vodíka za prítomnosti týchto kovov prebieha rýchlejšie. Nikel, paládium a platina sú preto výbornými katalyzátormi.
Chemické vlastnosti sú podmienené stavbou atómu a postavením v periodickej tabuľke. Pri zlučovaní vodíka sa elektrónový obal mení dvojako:
- Pribraním jedného elektrónu, nadobudne elektrónový obal konfiguráciu najbližšieho vzácneho plynu hélia, čím sa mení na anión H−.
- Stratou jediného elektrónu sa atom vodíka mení na protón. Protón (katión vodíka H+) sa vo vodných roztokoch viaže na voľný elektrónový pár kyslíka a tým sa vytvorí hydroxóniový katión H3O+
- H+ + H2O → H3O+

Friedrich Wilhelm Ostwald (* 2. september 1853, Riga – † 4. apríl 1932, Lipsko) bol nemecký fyzikálny chemik a filozof, nositeľ Nobelovej ceny (1909) za práce o katalýze a výskumy podmienok chemickej rovnováhy a reakčných rychlostí.
Ostwald sa narodil v Rige (v minulosti patrila pod Rusko, teraz Lotyšsko), ako syn Gottfrieda Wilhelma Ostwalda a Elisabeth Leuckelovej. Vyštudoval v roku 1875 na Univerzite v Tartu a vyučoval tam od 1875 do roku 1881. V roku 1887 odišiel do Lipska, kde pracoval po zvyšok života. Ostwald bol členom Medzinárodného Výboru pre Atómové hmotnosti. Počas 1. svetovej vojny toto členstvo bolo natrvalo ukončené v roku 1917. Podľa publikovaných prác, Wilhelm Ostwald bol veľmy produktívny v širokých oblastiach chémie. Publikoval prácu, ktorá obsahovala značné množstvo filozofických spisov, ktorá obsahovala takmer 40 tisíc strán. Na konci jeho extrémne plodného života, Ostwald zomrel v nemocnici 4. apríla 1932.
Je mu najčastejšie pripisovaný objav Ostwaldovho procesu (patentovaný v roku 1902), ktorý sa používa na priemyselnú výrobu kyseliny dusičnej. I keď tento proces bol známy už 64 rokov skôr vďaka Kuhlmannovy, bol nezaujímavý pre vtedajšiu dobu, kvôli malému množstvu potrebného amoniaku. Tento proces by bol nevýznamný aj v roku 1902 avšak vďaka práce Habera a Bosha sa prudko zvýšila produkcia amoniaku vďaka ich technike oddelovania dusíka Haberovym procesom (dokončený v roku 1911 alebo 1913). Rok 1908 (šesť rokov po patente) je často prikladaný ku objavu Ostwaldovmu procesu. Je možné že objav oddeľovania dusíka motivoval Ostwalda ku komercionalizázii jeho procesu. Alternatívne, 6 rokov, mohla byť byrokratická doba kým jeho proces dostal patent.
Kombináciou týchto dvoch prelomových procesov sa zvýšila produkcia dusíka, bola zväčšená sila výbušnín. To využilo Nemecko počas 1. svetovej vojny. Ostwald taktiež vytvoril zaujímavú teóriu ktorá viedla ku objaveniu Zákonu riedenia ktorý je pomenovaná poňom. Slovo mól, podľa Gorina, bolo predstavené chémickému svetu v roku 1900 Ostwaldom. Ostwald definoval jeden mól ako molekulovú váhu látky ku hmotnosti látky. Podľa Ostwalda, tento koncept bol prepojený so vzácnymi plynmi. Iróniou bolo, že Ostwaldov koncept mólu priamo protirečil s jeho atómovou teóriou. Počas rozhovoru s Arnoldom Sommerfeldom vysvetlil, že bol ovplivnený Einsteinovým vysvetlením Brownovho pohybu.

Dmitrij Ivanovič Mendelejev ( rusky: Дми́трий Ива́нович Менделе́ев) (* 8. február 1834, Toboľsk – † 2. január 1907, Petrohrad) bol ruský chemik, ktorý bol jedným z dvoch vedcov, ktorí vytvorili prvú verziu periodickej tabuľky chemických prvkov. Tvrdil, že prvky boli usporiadané do vzoru, ktorý mu umožnil predpovedať vlastnosti prvkov, ktoré ešte neboli objavené.
Zdroj:
Text je dostupný za podmienok Creative Commons Attribution/Share-Alike License 3.0 Unported; prípadne za ďalších podmienok. Podrobnejšie informácie nájdete na stránke Podmienky použitia.
Antropológia
Aplikované vedy
Bibliometria
Dejiny vedy
Encyklopédie
Filozofia vedy
Forenzné vedy
Humanitné vedy
Knižničná veda
Kryogenika
Kryptológia
Kulturológia
Literárna veda
Medzidisciplinárne oblasti
Metódy kvantitatívnej analýzy
Metavedy
Metodika
Text je dostupný za podmienok Creative
Commons Attribution/Share-Alike License 3.0 Unported; prípadne za ďalších
podmienok.
Podrobnejšie informácie nájdete na stránke Podmienky
použitia.
www.astronomia.sk | www.biologia.sk | www.botanika.sk | www.dejiny.sk | www.economy.sk | www.elektrotechnika.sk | www.estetika.sk | www.farmakologia.sk | www.filozofia.sk | Fyzika | www.futurologia.sk | www.genetika.sk | www.chemia.sk | www.lingvistika.sk | www.politologia.sk | www.psychologia.sk | www.sexuologia.sk | www.sociologia.sk | www.veda.sk I www.zoologia.sk













